Агрегатные состояния вещества и их характеристика. Плазма. Стекла и аморфные вещества. Понятие о ближнем и дальнем порядках.
Агр. состояния в-ва: твёрдые(кристалическое строение, имеют форму, имеют свойство спайности, присутствует дальний и близкий порядок), , жидкие(малая сжимаемость, хорошо сохраняет объём, не способна сохранять форму, только дальний порядок) , гозообразные(хорошая сжимаемость, не сохраняет объём и форму, стремится занять весь объём, расстояние м\у малекулами больше их размера), плазма(отличается от газа большой степенью ионизации атомов).
Стекло — твердотельное состояние аморфных веществ. Аморфные вещества могут находиться либо в стеклообразном состоянии (при низких температурах), либо в состоянии расплава (при высоких температурах). Аморфные вещества переходят в стеклообразное состояние при температурах ниже температуры стеклования T. При температурах свыше T, аморфные вещества ведут себя как расплавы, то есть находятся в расплавленном состоянии.
Ам́орфные веществ́а не имеют кристаллической структуры и в отличие от кристаллов не расщепляются с образованием кристаллических граней, как правило — изотропны, то есть не обнаруживают различных свойств в разных направлениях, не имеют определённой точки плавления
Ближний порядок — упорядоченность во взаимном расположении атомов или молекул в веществе, которая (в отличие от дальнего порядка) повторяется лишь на расстояниях, соизмеримых с расстояниями между атомами, то есть ближний порядок это наличие закономерности в расположении соседних атомов или молекул.
Ближним порядком в расположении атомов или молекул обладают, наряду с кристаллами,также аморфные тела и жидкости.
Дальний порядок — упорядоченность во взаимном расположении атомов или молекул в веществе (в жидком или твёрдом состоянии), которая (в отличие от ближнего порядка) повторяется на неограниченно больших расстояниях.
Дальним порядком в расположении атомов или молекул обладают, например, кристаллы.
20. Энергетический (тепловой) эффект изохорного и изобарного химических процессов. Стандартная энтальпия образования химического соединения. Закон Гесса и следствия из него.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
§ Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
§ В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Стандартная энтальпия образования обозначается ΔHfO
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
§ Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
§ Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
§ Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
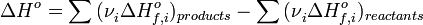
§ Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
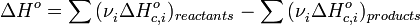
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
§ Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
