Эквивалент. Закон эквивалентов
Примеры решения задач
Пример 1. Рассчитайте эквивалентную массу трёхвалентного металла (M), навеска которого массой 1,44 г при его полном окислении превращается в 2,72 г соответствующего оксида. Какой металл используется в качестве исходного реагента?
Решение. На основании закона эквивалентов составим пропорцию
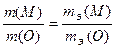 .
.
Здесь m – масса реагента, 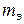 - его эквивалентная масса.
- его эквивалентная масса.
Таким образом, 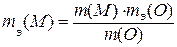
Из условия задачи находим m(O)=m(окс.)-m(M)=2,72 – 1,44 =1,28 (г).
Учтя, что 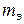 (O) = 8
(O) = 8 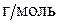 , получим
, получим
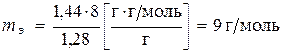 .
.
По определению грамм-атомная масса (A) простого вещества равна произведению его эквивалентной массы на валентность (υ)
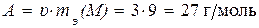 .
.
В итоге, сравнив найденный результат с значениями средних масс, указанными в таблице Менделеева, приходим к выводу, что в качестве металла был использован алюминий.
Пример 2. Сколько граммов цинка растворилось в соляной кислоте, если известно, что в ходе этой реакции выделилось 1,2 л водорода.
Решение.С учётом объёмных отношений газообразных реагентов, из закона эквивалентов следует, что
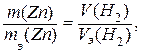
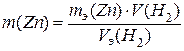 ,
,
где m - масса металла, 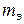 - его эквивалентная масса, V – объём газообразного продукта реакции,
- его эквивалентная масса, V – объём газообразного продукта реакции, 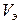 - его грамм-эквивалентный объём.
- его грамм-эквивалентный объём.
Из данных таблицы Менделеева определим, что
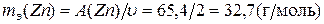
Учтя, что 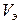 (
( 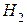 )=11,2 л, получим окончательно:
)=11,2 л, получим окончательно:
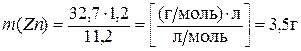
Пример 3. Определите мольную массу эквивалентов ортофосфорной кислоты в реакции её нейтрализации гидроксидом калия с образованием соответствующего моногидрофосфата.
Решение.Из уравнения указанной реакции
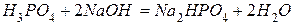
следует, что число эквивалентности 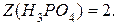
Таким образом, 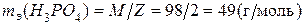 .
.
Пример 4.Рассчитайте мольную массу эквивалентов перманганат-анионов, восстанавливаемых в кислой среде водного раствора.
Решение.В кислой среде осуществляется следующая полуреакция восстановления:
MnO-4
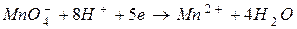
Как видно, Z = 5, 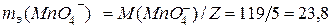 (г / моль).
(г / моль).
Контрольные задания
1.Составьте уравнения реакции полного (до 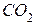 ) и неполного (до
) и неполного (до 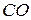 ) окисления графита при его сгорании в атмосфере кислорода. Определите эквивалентные массы углерода в указанных реакциях.
) окисления графита при его сгорании в атмосфере кислорода. Определите эквивалентные массы углерода в указанных реакциях.
Ответ: 3 и 6 (г/ моль-экв.)
2. Молярная масса эквивалента сульфида металла равна 36 г/ моль. Определите атомную массу металла и идентифицируйте его, учтя что валентность металла равна двум.
Ответ: 40 г/ моль.
3. При соединении серы с 5,6 г железа образовалось 8,8 г сульфида железа. Вычислите эквивалентную массу металла и его эквивалент, если известно, что сера в образуемом сульфиде двухвалентна.
Ответ: 28 г/ моль-экв.
4. Составьте уравнение реакции кальция с водным раствором хлорида алюминия, при котором образуется комплексное соединение 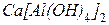 . Вычислите эквивалентную массу
. Вычислите эквивалентную массу 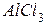 в этой реакции.
в этой реакции.
Ответ: 33,4 г / моль-экв.
5. Как определяются эквивалентные массы многоосновных кислот и многоосновных оснований? Найдите эквивалентную массу ортофосфорной кислоты в реакции
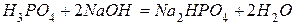 .
.
Ответ: 49 г / моль-экв.
6. Одна и та же масса металла соединяется с 2,51 г галогена и с 180 см3 О2. Вычислите эквивалентную массу галогена.
Ответ: 79,9 г / моль-экв.
7. Вычислите эквивалентную массу бихромат-аниона при его восстановлении в кислой среде по схеме:
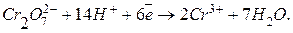
Ответ: 36 г / моль-экв.
8. Избытком гидроксида натрия подействовали на водные растворы: а) хлорида алюминия, б) гидроксохлорида алюминия. Составьте уравнения реакций и определите эквивалентные массы указанных веществ.
Ответ: 26; 57,5 (г / моль-экв.)
9. Чему равны эквивалентные массы воды при ее реакциях:
а) с металлическим барием, б) оксидом бария?
Ответ: а) 18, б)9 (г / мол-экв.)
10. В какой массе гидроксида кальция находится столько же грамм-эквивалентов, сколько их содержится в 147 г ортофосфорной кислоты?
Ответ: 166,5 г.
11. На нейтрализацию 1,35 г серной кислоты израсходовано 1,1 г гидроксида щелочного металла. Какова формула этого гидроксида?
12. (см. ранее 18) Фосфор образует два различных по составу хлорида. Эквивалент какого элемента сохраняется постоянным? Назовите величины эквивалентных масс P и Cl в указанных соединениях.
Ответ: а) 10,3 и 35,5; б) 6,2 и
35,5 (г / моль экв.).
13. В состав соединения входит 24,8 % калия, 34,7 % марганца и 40,5 % (мас.) кислорода. Какова его эмпирическая формула и эквивалентная масса?
Ответ: 158,0 г / моль-экв.
14. При разложении 0,7 г оксида металла выделилось 36,2 мл кислорода, измеренного при нормальных условиях. Найдите эквивалентные массы оксида и металла.
Ответ: 108,3; 100,3 (г / моль-экв.).
15. Найдите простейшую формулу кислородного соединения хлора и его эквивалентную массу, если известно, что оно содержит 38,76 % (мас.) галогена.
Ответ: 13,1 г / моль-экв.
16. Навеска металла массой 5 г вытесняет из кислоты 4,61 л водорода и 13,1 г меди из раствора ее соли. Вычислите эквивалентные массы неизвестного металла и меди. Чему равна валентность последней?
Ответ: 12,2; 31,8 (г / моль-экв.).
17. В оксиде на два атома металла приходится три атома кислорода. Вычислите атомную массу металла, если известно, что содержание кислорода в его оксиде составляет 47% (масс.).
Ответ: 27,1 г / моль.
18. Назовите эквивалент и определите эквивалентную массу катионов свинца в приведенных реакциях:
а) Pb4+ + 2 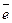 = Pb2+ , б) Pb4+ + 4 OH- = Pb(OH)4.
= Pb2+ , б) Pb4+ + 4 OH- = Pb(OH)4.
Ответ: а) 103,6,
б) 51,8 (г / моль-экв.)
19. Эквивалентная масса трехвалентного металла равна 68,1 г/моль. Вычислите атомную массу металла, эквивалентную массу оксида и процентное содержание кислорода в оксиде.
Ответ: 204,3 г / моль-экв;
76,3 г / моль-экв; 10,5 % (масс.).
20. Молярная масса эквивалента металла составляет 23,8 г/ моль. Рассчитайте массовую долю металла в оксиде.
Ответ: 74,8 % (мас.).
СТРОЕНИЕ АТОМОВ
Введение
Современная теория строения атомов и молекул базируется на законах движения микрочастиц, обладающих очень малой массой, порядка 10-27 – 10-31 кг. Эти законы были сформулированы в 1923-27 годах и привели к созданию новой науки – квантовой механики. Установлено, что поведение микрочастиц принципиально отличается от поведения микрообъектов, изучаемых классической механикой.
Применение законов квантовой механики к химическим явлениям привело к созданию квантовой химии, которая является основой современной теории химической связи и строения вещества.
Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, m1). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (m1) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (n, l, ml, и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число m1(магнитное) – магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны и атомы должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому на АО могут находиться не более двух электронов, различающихся своими спинами ms = ± 1/2. Заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке возрастания числа n. Соответственно по этому правилу последовательность заполнения энергетических уровней и подуровней следующая:
1s2 < 2s2 < 2p6 < 3s2 < 3p6 < 4s2 < 3d10 < 4p6 < 5s2 < 4d10 < 5p6 < 6s2
< 5d1 < 4f14 < 5d9 < 6p6 < 7s2 < 6d1 < 5f14 < 6d9 < 7p6 < 8s2……
Примеры решения задач
Пример 1.Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях.
Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20):
16S – 1s2 2s2 2p6 3s2 3p4
Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:














 3s 3p 3d
3s 3p 3d
 16S - ...
16S - ...
 Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS.
У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали.
Представим электронные конфигурации атома серы в возбужденных состояниях:
3s 3р 3d
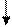

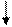

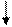


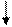

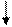




 а) 16S* - … , 16S* - … 3s23p33d1
а) 16S* - … , 16S* - … 3s23p33d1
Валентность серы равна 4, например, в соединениях SO2, H2SO3
3s 3p 3d














 б) 16S*- … S* - … 3s1 3p3 3d2
б) 16S*- … S* - … 3s1 3p3 3d2
Валентность серы равна 6, например, в соединениях: SO3, H2SO4.
Вывод: валентность серы в соединениях 2, 4, 6.
Пример 2.Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана.
Решение. Порядок заполнения энергетических уровней и подуровней следующий:
22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2
Титан принадлежит к d-электронному семейству.
Электронная формула титана имеет вид:
22Ti – 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Подчеркнуты валентные электроны.
Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях:
3d 4s 4p 4d 4f
















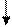


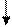
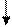



 22 Ti -…
22 Ti -…
Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3.
При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4):
3d 4s 4p 4d 4f
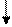
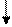





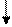

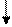














 22Ti*-…
22Ti*-…
22 Ti* - … 3d2 4s1 4p1 4d0 4f0
Сокращенная электронная формула атома титана:
22 Ti - … 3d2 4s2
Электронные аналоги титана:
40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2
Электронные формулы ионов титана Ti2+ и Ti4+ соответственно:
22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0.
Контрольные задания
21. Структуры валентных электронных слоев выражаются формулами: а) 4s24p2;
б) 5d46s2; в) 4s1. Составьте полные электронные формулы, определите порядковые номера, приведите названия элементов, определите принадлежность к электронным семействам.
22. Напишите электронную формулу атома кислорода. Какие элементарные частицы входят в состав атома? Рассчитайте длину волны де Бройля для молекулы кислорода, движущейся со скоростью 1000 м/с, учтите единицы измерения Джоуля [м2×кг×с-2]. Возможно ли обнаружение волновой природы этой частицы?
23. В чем сущность a, b-, b+ - радиоактивного распада? Изотопы какого элемента получатся в результате последовательного излучения 4a- и 2b-частиц атомным ядром 238U? Напишите сокращенную электронную формулу полученного изотопа элемента. Является ли полученный изотоп устойчивым или радиоактивным?
24. Напишите электронные формулы атома Te и иона Te2-. Докажите, что валентность теллура в соединениях 2, 4, 6.
25. Напишите электронные формулы атома железа, ионов Fe2+ и Fe3+. Докажите с помощью электронно-графической схемы, что максимальная валентность железа в соединениях равна 6.
26. Что такое изотопы? Приведите примеры изотопов какого-либо элемента, напишите электронную формулу изотопов этого элемента. Почему изотопы элемента имеют сходные химические свойства?
27. Определите по правилу Клечковского последовательность заполнения электронами энергетических подуровней, если n+l=7. Какой элемент имеет валентные электроны 7s2?
28. Напишите электронные формулы атома стронция и иона Sr2+. Укажите валентность стронция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома стронция?
29. Напишите значения всех четырех квантовых чисел для трех любых электронов на 4p-подуровне. Значениями какого квантового числа различаются три электрона указанного подуровня? Почему максимальное число электронов на p-подуровне равно 6?
30. По какому признаку элементы подразделяются на электронные семейства? Напишите электронные формулы атомов любых двух элементов пятого периода, принадлежащих к разным электронным семействам. Какие электроны этих элементов являются валентными? Какой подуровень заполняется раньше: 5s или 4d? Почему?
31. Какое состояние атома называется основным и какое – возбужденным? Чем ион отличается от нейтрального атома? Ответы на вопросы подтвердите написанием электронных формул атома брома и бромид-иона. Изобразите электронно-графические схемы атома брома в нормальном и возбужденных состояниях.
32. Напишите электронные формулы атома водорода и ионов Н+, Н-. Какие элементарные частицы входят в состав атома водорода и ионов? Вычислите энергию связи электрона в электрон-Вольтах (эВ) на первой и пятой стационарных орбиталях атома водорода и сравните (<, >) их величины.
33. Структуры валентных электронных слоёв атомов элементов выражаются формулами:
а) 5s25p4; б) 3d54s1; в) 7s2. Определите порядковые номера, приведите названия элементов, а также укажите принадлежность к электронным семействам.
34. Составьте электронные формулы и электронно-графические схемы атомов элементов с порядковыми номерами 23 и 33 в нормальном и возбужденных состояниях. Приведите валентные электроны этих элементов и их электронных аналогов.
35. На примерах галлия и марганца докажите, что имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д.И. Менделеева.
36. Напишите электронные формулы и электронно-графические схемы атомов фосфора и ванадия в нормальном и возбужденном состояниях. К какому электронному семейству относится каждый из этих элементов?
37. На каком основании иттрий (Z=39) и индий (Z=49) помещены в одну группу периодической системы элементов Д.И. Менделеева? Почему они в разных подгруппах? Приведите валентные электроны этих элементов и их электронных аналогов.
38. Напишите электронные формулы атома Ba и иона Ba2+. Какую валентность проявляет барий в нормальном и возбужденном состояниях? Структуру какого инертного газа имеет ион Ba2+?
39. Напишите электронную формулу атома технеция. Укажите валентные электроны. Распределите валентные электроны по энергетическим ячейкам в нормальном и возбужденном состояниях. Определите суммарный спин электронов в возбужденном состоянии.
40. Напишите электронную формулу атома меди; учтите, что у меди происходит провал одного 4s электрона на 3d-подуровень. Приведите электронные формулы двух последних уровней электронных аналогов меди.
