Общая характеристика инструментальных методов анализа
Инструментальные методы анализа — количественные аналитические методы, для выполнения которых требуется электрохимическая оптическая, радиохимическая и иная аппаратура. К инструментальным методам анализа обычно относят:
¾ электрохимические методы — потенциометрию, полярографию, кондуктометрию и др.;
¾ методы, основанные на испускании или поглощении излучения,— эмиссионный спектральный анализ, фотометрические методы, рентгеноспектральный анализ и др.;
¾ масс-спектральный анализ;
¾ методы, основанные на измерении радиоактивности.
Все инструментальные (физические и физико-химические) методы основаны на измерении физических величин, характеризующих объект анализа (пробу).
Измеряемая в ходе анализа физическая величина, функционально связанная с содержанием только определяемого компонента Х в исследуемом объекте, называется аналитическим сигналом.
Для каждого метода характерен свой аналитический сигнал. В таблице 1 приведены примеры сигналов и соответствующих им методов, относящихся к двум важнейшим группам – оптическим и электрохимическим методам анализа.
Таблица 1
Примеры инструментальных методов анализа
| Группа методов | Методы (примеры) | Аналитический сигнал | Вид градуировочной функции | |
| Первичный, I | Вторичный, I* | |||
| Оптические | Атомно-эмиссионный спектральный анализ | Фототок, i; относительное почернение, DS | i = a Cb DS = a + k lg C | |
| Спектрофотометрия | Оптическая плотность, А | D = e l C | ||
| Электрохимические | Потенциометрия | Э.д.с. электрохими-ческой ячейки, DЕ | Потенциал электрода, Е | Е = a + b lgC |
| Вольтамперометрия | Сила тока, i | Предельный диффузионный ток, id | Id = kC |
Зависимость аналитического сигнала от содержания Х называют градуировочной функцией. Ее записывают как уравнение вида I = f (C). В этом уравнении символом С обозначают содержание Х, выраженное в единицах количества вещества (моль), единицах массы (кг, г) или концентрации (моль/л и др.); эти величины прямо пропорциональны друг другу. Величину сигнала в общем случае обозначают символом I, хотя в отдельных методах используют специфические обозначения (таблица 1). В каждом методе градуировочные функции однотипны, но точный вид градуировочной функции для конкретной методики зависит от природы Х и условий измерения сигнала.
Во многих методах зависимость сигнала от концентрации описывается нелинейными функциями, например, в люминесцентном анализе – показательной (I = kCn ), в потенциометрии - логарифмической (I = I0 + k lgC ), и т.д. Однако все градуировочные функции схожи тем, что по мере возрастания С величина I изменяется непрерывно, а каждому значению С соответствует единственное значение I.
Рисунок 1
Типичные градуировочные графики для некоторых инструментальных методов
|
| I |
|
|
|
|
К наиболее применимым электрохимическим методам анализа относятся потенциометрический, полярографический и кондуктометрический.
§2. Классификация оптических методов
К оптическим методам относятся рефрактометрия, поляриметрия, абсорбционные оптические методы.
Рефрактометрический анализ основан на измерении показателя преломления (рефракции) веществ, по которому следует судить о природе вещества, чистоте и содержании в растворах.
Преломление луча света возникает на границе двух сред, если среды имеют различную плотность. Отношение синуса угла падения (α) к синусу угла преломления (β) называют относительным показателем преломления (п) второго вещества по отношению к первому и является величиной постоянной:
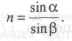
Показатель преломления вещества зависит от его природы, а также от длины волны света и от температуры.
Поляриметрический методоснован на свойстве некоторых веществ изменять направление световых колебаний.
Вещества, обладающие свойством изменять направление колебаний при прохождении через них поляризованного света, называются оптически активными. У поляризованного луча, пропущенного через слой раствора оптически активного вещества, меняется направление колебаний, а плоскость поляризации оказывается повернутой на некоторый угол, называемый углом поворота плоскости поляризации, который зависит от поворота плоскости поляризации, концентрации и толщины слоя раствора, длины волны поляризованного луча и температуры.
Оптические абсорбционные методы— это методы анализа, основанные на поглощении электромагнитного излучения анализируемыми веществами. Именно оптические абсорбционные методы получили широкое распространение в научно-исследовательских и сертификационных лабораториях. При поглощении света атомы и молекулы поглощающих веществ переходят в новое возбужденное состояние.
В зависимости от вида поглощающих веществ и способа трансформирования поглощенной энергии различают атомно-абсорбционный, молекулярно-абсорбционный анализ, нефелометрию и люминесцентный анализ.
Атомно-абсорбционный анализоснован на поглощении световой энергии атомами анализируемых веществ.
Молекулярный абсорбционный анализоснован на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой, видимой и инфракрасной областях спектра (спектрофотометрия, фотоколориметрия, ИК-спектроскопия).
Фотоколориметрия и спектрофотометрияоснованы на взаимодействии излучения с однородными системами, их обычно объединяют в одну группу фотометрических методов анализа.
Нефелометрия основана на поглощении и рассеянии световой энергии взвешенными частицами анализируемого ве-щества.
Люминесцентный (флуорометрический) анализоснован на измерении излучения, возникающего в результате выделения энергии возбужденными молекулами анализируемого вещества.
Люминесценцией называют свечение атомов, ионов, молекул и других более сложных частиц вещества, которое возникает в результате перехода в них электронов при возвращении из возбужденного в нормальное состояния.
§3. Основные законы фотометрического анализа и формулы.
Фотометрический анализ относится к абсорбционным методам, т.е. основан на измерении поглощения света веществом. Он включает спектрофотометрию, фотоколориметрию и визуальную фотометрию, которую обычно называют колориметрией.
Каждое вещество поглощает излучение с определенными (характерные только для него) длинами волн, т.е. длина волны поглощаемого излучения индивидуальна для каждого вещества, и на этом основан качественный анализ по светопоглошению.
Основой количественного анализа является закон Бугера-Ламберта-Бера:
А = e l c
где А = –lg (I / I0) = –lg T – оптическая плотность;
I0 и I – интенсивность потока света, направленного на поглощающий раствор и прошедшего через него;
с – концентрация вещества, моль/л;
l – толщина светопоглощающего слоя;
e - молярный коэффициент светопоглощения;
T - коэффициент пропускания.
Для определения концентрации анализируемого вещества наиболее часто используют следующие методы:
1) молярного коэффициента светопоглощения;
2) градуировочного графика;
3) добавок;
4) дифференциальной фотометрии;
5) фотометрического титрования.
Метод молярного коэффициента поглощения. При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Аст, для каждого раствора рассчитывают e = Аст / (lсст) и полученное значение e усредняют. Затем измеряют оптическую плотность анализируемого раствора Ах и рассчитывают концентрацию сх по формуле
сх = Ах /(el).
Ограничением метода является обязательное подчинение анализируемой системы закону Бугера-Ламберта-Бера, по крайней мере, в области исследуемых концентраций.
Метод градуировочного графика. Готовят серию разведений стандартного раствора, измеряют их поглощение, строят график в координатах Аст – Сст. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию.
Метод добавок. Этот метод применяют при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов. Сущность его заключается в следующем. Сначала определяют оптическую плотность Ах анализируемого раствора, содержащего определяемый компонент неизвестной концентрации сх, а затем в анализируемый раствор добавляют известное количество определяемого компонента (сст) и вновь измеряют оптическую плотность Ах+ст.
Оптическая плотность Ах анализируемого раствора равна
Ах = e l cх,
а оптическая плотность анализируемого раствора с добавкой стандартного
Ах+ст = e l (cх + сст).
Концентрацию анализируемого раствора находим по формуле:
сх = сст Ах / (Ах+ст – Ах).
Метод дифференциальной фотометрии. Если в обычной фотометрии сравнивается интенсивность света, прошедшего через анализируемый раствор неизвестной концентрации, с интенсивностью света, прошедшего через растворитель, то в дифференциальной фотометрии второй луч света проходит не через растворитель, а через окрашенный раствор известной концентрации – так называемый раствор сравнения.
Фотометрическим методом можно определять также компоненты смеси двух и более веществ. Эти определения основаны на свойстве аддитивности оптической плотности:
Асм = А1 + А2 + …+ Аn
где Асм - оптическая плотность смеси; А1 , А2, Аn – оптические плотности для различных компонентов смеси.
Фотометрические методы анализа применяются для контроля разнообразных производственных процессов. Эти методы могут быть применены для анализа больших и малых содержаний, но особенно ценной их особенностью является возможность определения примесей (до 10-5...10-6%). Методы абсорбционной спектроскопии используют в химической, металлургической, фармацевтической и других отраслях, а также в медицине и сельскохозяйственном производстве.
§4. Лабораторная работа
