Электролитическая диссоциация слабой кислоты – опыт 1
1. Цель работы – познакомиться с основными физико-химическими величинами, характеризующими поведение слабых кислот в водных растворах: их концентрацией, рН раствора, степенью диссоциации, константой равновесия; научиться выполнять расчеты для перехода от одних характеристик к другим. Исследовать влияние концентрации кислоты на ее степень диссоциации и константу равновесия.
2.Работа выполняется на ЭВМ по имеющейся программе в соответствии с указаниями, которые появляются на экране монитора.
3. Теоретическое введение.
Слабые электролиты диссоциируют в растворе не полностью, т.е. их степень диссоциации меньше 100%. Для равновесия диссоциации слабой кислоты HA имеем:
HA ↔ H+ + A–, (1)
C0 – x x x
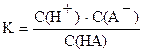 . (2)
. (2)
Константу равновесия (2), выраженную через концентрации, можно считать постоянной и не зависящей от концентрации как самой кислоты, так и других ионов и молекул, присутствующих в растворе. Это – основное свойство константы равновесия (2), на котором основаны все расчеты равновесий с участием слабых электролитов.
В выражение (2) входят равновесные концентрации ионов и исходных молекул HA, т.е. такие, которые получились после установления равновесия в системе (1) и уже не изменяются со временем. Поэтому величина C(HA) меньше C0 на величину C(диссоц.), которую мы примем за x. Здесь C0 – начальная (аналитическая) концентрация HA, которая была бы, если бы кислота не диссоциировала в растворе; C(диссоц.) – концентрация продиссоциировавшей кислоты.
Как следует из уравнения (1), 1 моль HA образует при диссоциации по одному молю ионов H+ и A–. Поэтому для чистой кислоты имеем:
C(диссоц.) = x = C(H+) = C(A–). (3)
Таким образом, константа равновесия (2) может быть определена по уравнению
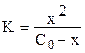 . (4)
. (4)
Степень диссоциации HA, т.е. доля продиссоциировавших молекул, равна:
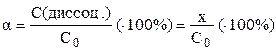 . (5)
. (5)
В отличие от константы равновесия, степень диссоциации слабого электролита зависит от его концентрации – характер этой зависимости можно получить, выразив x в уравнении (5) через α и C0 и подставив его в уравнение (4). При α << 1 получаем ее простую зависимость от C0.
4. Методика выполнения (ход работы).
До начала выполнения лабораторной работы необходимо получить от преподавателя название слабой кислоты HA и концентрацию ее раствора C1 (раствор 1), который необходимо «приготовить» в мерной колбе на 100 мл из имеющегося 1,5 М раствора этой кислоты.
Расчет объема исходного раствора кислоты (Vисх) с концентрацией 1,5 М (Cисх), который необходимо взять для приготовления в мерной колбе на 100 мл (V1) раствора кислоты заданной концентрации (C1) основан на том, что при разбавлении водой исходной кислоты количество вещества (ν молей или миллимолей) в мерной колбе не изменяется:
ν = Cисх·Vисх = C1·V1. (6)
Требующийся объем кислоты вычисляется с обычной в аналитической практике точностью ± 0,01 мл. Правильность полученной величины Vисх может быть проверена на ЭВМ. Ход выполнения работы изложен в [2].
5. Результаты работы.
После ввода всех исходных данных в ЭВМ она выдает величину рН приготовленного раствора 1: рН1 = – lg C(H+) = – lg x. Расчеты константы равновесия и степени диссоциации производятся по уравнениям (4) и (5). Правильность полученной величины K может быть проверена по справочнику [5], а α – на ЭВМ.
Выполнение работы повторяется ещё 2 раза, каждый раз уменьшая объем исходного раствора кислоты (Vисх) в 3–5 раз.
Полученные результаты необходимо представить в форме таблицы 1.
1. Таблица 1 – Результаты измерений и расчетов
для раствора кислоты HA =
| № | Взято Vисх кислоты, мл | Концентрация кислоты, C1 | рН1 | С(Н+), М | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
2. Таблица 1 – Результаты измерений и расчетов
для раствора кислоты HA =
| № | Взято Vисх кислоты, мл | Концентрация кислоты, C1 | рН1 | С(Н+), М | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
3. Таблица 1 – Результаты измерений и расчетов
для раствора кислоты HA =
| № | Взято Vисх кислоты, мл | Концентрация кислоты, C1 | рН1 | С(Н+), М | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
4. Таблица 1 – Результаты измерений и расчетов
для раствора кислоты HA =
| № | Взято Vисх кислоты, мл | Концентрация кислоты, C1 | рН1 | С(Н+), М | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
5. Таблица 1 – Результаты измерений и расчетов
для раствора кислоты HA =
| № | Взято Vисх кислоты, мл | Концентрация кислоты, C1 | рН1 | С(Н+), М | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
6. Заключение (выводы):
– проведено ознакомление с основными физико-химическими величинами, характеризующими поведение слабых кислот в водных растворах: их концентрацией, рН раствора, степенью диссоциации, константой равновесия;
– освоено выполнение расчетов для перехода от одних характеристик к другим;
– установлено, что константа равновесия не зависит от концентрации кислоты;
– установлено, что степень диссоциации слабой кислоты с уменьшением ее концентрации возрастает.
Лабораторная работа № 2
Электролитическая диссоциация слабой кислоты при добавлении в раствор сильной кислоты (опыт 2) или щелочи (опыт 3)
1. Цель работы – познакомиться с химическими реакциямив растворах слабых кислот, к которым добавлены небольшие количества сильной кислоты или щелочи, с влиянием одноименных ионов на диссоциацию слабой кислоты; научиться выполнять расчеты этих равновесий.
2.Работа выполняется на ЭВМ по имеющейся программе в соответствии с указаниями, которые появляются на экране монитора.
3. Теоретическое введение.
Опыт 2. При добавлении к раствору слабой кислоты HA концентрации С1 некоторого количества сильной кислоты, например соляной HCl, в растворе происходят следующие изменения, которые влияют на равновесие реакции (1):
– концентрация HA уменьшается, что должно приводить, как уже установлено, к увеличению степени диссоциации слабой кислоты;
– появляется дополнительное количество ионов H+:
HCl → H+ + Cl–, (7)
Ск Ск Ск
которые участвуют в равновесии реакции (1) и должны, в соответствии с принципом Ле-Шателье, смещать это равновесие влево, уменьшая степень диссоциации HA.
Результат этого разнонаправленного воздействия может быть любым, в зависимости от конкретных свойств HA и концентраций участвующих веществ – α может уменьшаться, может увеличиваться, а может оставаться почти постоянной. При этом константа равновесия не должна изменяться.
Начальная концентрация C0 кислоты HA, так же как и концентрация Ск (HCl), должна быть рассчитана по закону разбавления (6) из исходных концентраций и объемов растворов до и после смешения.
Опыт 3. При добавлении к раствору слабой кислоты HA концентрации С1 небольшого количества щелочи, например NaOH, в растворе происходят следующие изменения, которые влияют на равновесие реакции (1):
NaOH → Na+ + OH–, (8)
Сщ Сщ Сщ
HA + OH– → H2O + A–, (9)
Сщ Сщ
– концентрация HA уменьшается (реакция 9), что должно приводить к увеличению степени диссоциации слабой кислоты;
– ионы OH– реагируют с избытком кислоты, образуя дополнительное количество ионов A–. Эти избыточные анионы участвуют в равновесии реакции (1) и должны смещать это равновесие влево, уменьшая степень диссоциации HA.
Результат этого разнонаправленного воздействия, как и в предыдущем опыте, может быть любым, в зависимости от конкретных свойств HA и концентраций участвующих веществ – α может уменьшаться, может увеличиваться, а может оставаться почти постоянной. При этом константа равновесия также не должна изменяться.
Начальная концентрация C0 кислоты HA, так же как и концентрация Сщ анионов A–, должна быть рассчитана по закону разбавления (6) из исходных концентраций и объемов растворов до и после смешения с учетом происходящей реакции нейтрализации (9).
4. Методика выполнения (ход работы).
Опыт 2. В этом опыте используется «приготовленный» в работе 1 раствор HA концентрации C1. До начала выполнения лабораторной работы необходимо получить от преподавателя объем V1 этого раствора 1, который используется для «приготовления» раствора 2 путем смешения с разбавленным раствором HCl (указывается объем Vк и исходная концентрация этого раствора сильной кислоты). На ЭВМ «измеряется» рН полученного раствора.
Опыт 3. В этом опыте также используется «приготовленный» в работе 1 раствор HA концентрации C1. До начала выполнения лабораторной работы необходимо получить от преподавателя объем V1 этого раствора 1, который используется для «приготовления» раствора 3 путем смешения с разбавленным раствором NaOH (указывается объем Vщ и исходная концентрация этого раствора щелочи). На ЭВМ «измеряется» рН полученного раствора.
Ход выполнения работы изложен в [2].
5. Результаты работы.
После ввода всех исходных данных в ЭВМ она выдает величины рН2 и рН3 приготовленных растворов 2 и 3. Обработка этих результатов производится следующим образом.
Опыт 2. Находим общую концентрацию ионов водорода C2(H+) в объединенном растворе: рН2 = – lg C2(H+). Эта величина входит в выражение для вычисления константы равновесия (2). Эти ионы водорода образуются за счет двух химических реакций:
– при диссоциации НА (реакция 1), концентрацию этих ионов водорода можно обозначить x, причем анионы A– образуются в точно такой же концентрации;
– при диссоциации HCl, концентрация этих ионов водорода равна Ск.
Таким образом, C2(H+) = x + Ск, т.е. x = C2(H+) – Ск. Так находится концентрация анионов A–, необходимая для расчета константы равновесия (2). Найденная величина x используется также для расчета степени диссоциации НА по уравнению (5).
В данном опыте небольшая величина – концентрация анионов A–, равная x, находится как разность двух сравнительно больших величин (C2(H+) – Ск), поэтому к точности определения C2(H+), т.е. рН2, предъявляются особые требования. В некоторых случаях величины К и α получаются с большой ошибкой, поэтому для получения более точных величин может потребоваться повторное «измерение» рН с более высокой точностью (± 0,001), чем это обеспечивается обычным лабораторным рН-метром (± 0,01). На ЭВМ имеется соответствующая программа.
Полученные результаты необходимо представить в форме таблицы 2.
1. Таблица 2 – Результаты измерений и расчетов
для HA + HCl HA =
| Концентрация НА (C0) | рН2 | С2(Н+) | Ск | С(A–) = = x | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
2. Таблица 2 – Результаты измерений и расчетов
для HA + HCl HA =
| Концентрация НА (C0) | рН2 | С2(Н+) | Ск | С(A–) = = x | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
3. Таблица 2 – Результаты измерений и расчетов
для HA + HCl HA =
| Концентрация НА (C0) | рН2 | С2(Н+) | Ск | С(A–) = = x | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
4. Таблица 2 – Результаты измерений и расчетов
для HA + HCl HA =
| Концентрация НА (C0) | рН2 | С2(Н+) | Ск | С(A–) = = x | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
5. Таблица 2 – Результаты измерений и расчетов
для HA + HCl HA =
| Концентрация НА (C0) | рН2 | С2(Н+) | Ск | С(A–) = = x | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
Опыт 3. Находим концентрацию ионов водорода C3(H+) в объединенном растворе: рН3 = – lg C3(H+). Эта величина входит в выражение для вычисления константы равновесия (2). Она равна концентрации продиссоциировавших молекул НА (x), а также анионов, образовавшихся при диссоциации кислоты НА (реакция 1). Для определения общей концентрации анионов ее нужно сложить с концентрацией A– (Сщ), образовавшихся по реакции (9).
Полученные результаты необходимо представить в форме таблицы 3.
1. Таблица 3 – Результаты измерений и расчетов
для HA + NaOH HA =
| Концентрация НА (C0) | рН3 | С3(Н+) | Сщ | С(A–) | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
2. Таблица 3 – Результаты измерений и расчетов
для HA + NaOH HA =
| Концентрация НА (C0) | рН3 | С3(Н+) | Сщ | С(A–) | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
3. Таблица 3 – Результаты измерений и расчетов
для HA + NaOH HA =
| Концентрация НА (C0) | рН3 | С3(Н+) | Сщ | С(A–) | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
4. Таблица 3 – Результаты измерений и расчетов
для HA + NaOH HA =
| Концентрация НА (C0) | рН3 | С3(Н+) | Сщ | С(A–) | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
5. Таблица 3 – Результаты измерений и расчетов
для HA + NaOH HA =
| Концентрация НА (C0) | рН3 | С3(Н+) | Сщ | С(A–) | α, % | К диссоциации | ||
| Получено | По ЭВМ | Получено | [5] | |||||
6. Заключение (выводы):
– проведено ознакомление с химическими реакциями в растворах слабых кислот, к которым добавлены небольшие количества сильной кислоты или щелочи;
– изучено совместное влияние разбавления слабой кислоты и добавляемых одноименных ионов на ее диссоциацию;
– установлено, что константа диссоциации слабой кислоты при добавлении небольших количеств сильной кислоты или щелочи не изменяется, а степень диссоциации может уменьшаться, может увеличиваться, а может оставаться почти постоянной;
– освоено выполнение расчетов равновесий в растворах слабых кислот, к которым добавлены небольшие количества сильной кислоты или щелочи.
7. Список литературы:
1) Общие требования и правила оформления текстовых документов: СТП СМК 4.2.3 - 01-2011. – Могилев: МГУП, 2011. – 43 с.
2) Методические указания для выполнения лабораторных работ на ЭВМ: «Потенциометрическое изучение равновесия диссоциации слабых электролитов». Для студентов технологических, химико-технологических и химических специальностей вузов / Могилевский государственный университет продовольствия; О.Г. Поляченок, Л.Д. Поляченок. – Могилев, 2004. – 12 с.
3) Поляченок, О.Г. Физическая и коллоидная химия. Практикум: Учебное пособие / О.Г. Поляченок, Л.Д. Поляченок. – Минск: Лаб. полиграфии УО БГТУ, 2006. – 380 с. – С.245–267.
4) Поляченок, О.Г. Физическая и коллоидная химия. Конспект лекций: / О.Г. Поляченок, Л.Д. Поляченок. – Могилев: МГУП, 2008. – 196 с. – С. 131–147.
5) Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. – 8-е изд. – Л.: Химия, 1983. – 252 с.
