Электролитическая диссоциация
Растворы электролитов (кислот, оснований, солей) в отличие от растворов неэлектролитов:
-проводят электрический ток,
-не подчиняются законам Вант–Гоффа и Рауля.
Обе эти особенности обусловлены тем, что под влиянием растворителя молекулы электролита подвергаются электролитической диссоциации, т.е. распадаются на положительно и отрицательно заряженные ионы – катионы и анионы.
Различают сильные и слабые электролиты.
Сильные электролиты существуют в растворе только в виде ионов. К сильным электролитам принадлежат соединения с типично ионной связью и те соединения с полярной связью, которые легко трансфориируются в ионные соединения под влиянием молекул воды. К ним относится: а) сильные минеральные кислоты, например, HCl, HBr, HJ, HNO3, H2SO4, H2SeO4, HClO4; б) основания щелочных и щелочноземельных металлов; в) большинство солей.
Слабые электролиты образуют в растворе лишь небольшое число ионов, так как только часть их молекул диссоциирует на ионы. К ним относятся: а) слабые минеральные кислоты, например, HF, HCN, HNO2, H2SO3, H2S, H2CO3, H2SiO3, H3BO3, H3PO4, H3AsO4, H2Se, и большинство органических кислот; б) нерастворимые в воде основания, а так же NH4OH; в) некоторые соли: HgCl2, CdCl2, ZnCl2, Fe(CNS)3.
Процесс частичной диссоциации слабого электролита записывается следующим образом:
а) СH3COOH « CH3COO- + H+;
б) многоосновные соединения диссоциируют ступенчато.
1 ступень H2CO3 « H+ + HCO3- (кислый ион)
2 ступень HCO3- « H+ + CO32- (основной ион)
Ступенчатая диссоциация позволяет объяснить образование кислых и основных солей, например, Na(HCO3), (CuOH)2SO4.
Количественно процесс диссоциации можно охарактеризовать значениями: изотонического коэффициента i, степени электролитической диссоциации a, константы электролитической диссоциации Кд.
Степенью электролитической диссоциации a называется отношение числа молекул, распавшихсяна ионы, к общему числу молекул электролита растворе. Степень электролитической диссоциации и константы электролитической диссоциации Кд связаны соотношением (закон разбавление Оствальда):
КД=α2С/1-α, где С – молярная концентрация электролита, моль/л. Для слабых электролитов (α<1), поэтому: КД=α2С, откуда 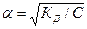 .
.
Вода – слабый электролит, диссоциирует в незначительной степени: H2O« H+ + OH-. Константа диссоциации процесса:
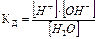
Произведение концентраций ионов H+ и OH- представляет собой постоянное при данной температуре значение и называется ионным произведением воды (КH2O). При 250С КH2O=10-14, отсуда [H+OH-]=[OH-]=10-7. Вместо концентраций ионов H+ и OH- пользуются значениями рН и рОН, которые называются водородным и гидроксильным показателями; рН=-lg[H+]; рОН==-lg[ОH+].
При 250С рН + рОН=14. В нейтральной среде рН=7, в кислой рН<7, в щелочной рН>7.
Для растворов электролитов вводится изотонический коэффициент i, который связан со степенью диссоиации электролита α соотношением:
i=1+ α(k-1), или α =(i-1)/(k-1).
Здесь k-число ионов, на которые распадается при диссоциации молекулы сильного электролита (для КСl k=2, для Na2SO4 k=3 и т.д.).
Пример 1.Чему равна степень электролитической диссоциации уксусной кислоты в водном растворе с концентрацией кислоты 0,001 моль/л? Контанта диссоциации уксусной кислоты КД=1,86 ·10-5.
Решение. Уравнение диссоциации уксусной кислоты в водном растворе выглядит так: СН3СООН 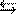 H++ СН3СОО-.
H++ СН3СОО-.
Концентрацию ионов можно определить таким образом:
[H+]=[СН3СОО-]=Са; [СН3СООН]=С-Са.
Выражение константы диссоциации примет вид
КД= 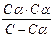 =α2 С/1-α
=α2 С/1-α
Если α « 1, то КД= α2 С, или 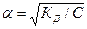 . Подставляя данные, получим α=
. Подставляя данные, получим α= 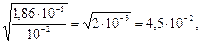 или 4.5%
или 4.5%
Пример 2.Вычислите рН 1%-го раствора муравьиной кислоты, считая, что плотность раствора равна 1 г/см3, КД=2,1 ·10-4.
Решение. 1 л раствора содержит 10 г НСООН, что состовляет 0,22 моль/л.
[H+]= 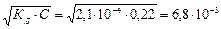 моль/л;
моль/л;
рН=3-lg6,8 = 2,17.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
157. Вычислите степень диссоциации α или молярную концентрацию См кислоты:
| Задание | кислота | КД | концентация | α |
| 157 а | С3Н7СООН | 1,5·10-5 | 0,005 М | ? |
| 157 б | HCN | 7,9·10-10 | 0,2 М | ? |
| 157 в | HNO2 | 4·10-4 | ? | 0,2 |
| 157 г | НСООН | 2·10-4 | ? | 0,05 |
158. Рассчитайте константу диссоциации гидрата аммиака NH3× H2O, если в растворе с концентрацией 0,2 моль/л степень его электролитической диссоциации равна 0,95%.
159.Вычислите степень электролитической диссоциации α и концентрацию ионов [H+] в растворе кислоты заданной концентрации:
| Задание | кислота | КД | концентация |
| 159 а | HCN | 6,2·10-10 | 0,1 M |
| 159 б | СНСl2СООН | 5·10-2 | 1 M |
| 159 в | ССl3СООН | 2·10-1 | 1 M |
| 159 г | НСlО2 | 1,1·10-2 | 1 M |
| 159 д | НIО3 | 1,6·10-1 | 1 M |
| 159 е | СН3СООН | 1,8·10-5 | 1% (ρ=1г/мл) |
| 159 ж | H2SO3 | 6,3·10-8 | 0,02 M |
| 159 з | HF | 6,8·10-4 | 0,3 M |
| 159 и | HF | 6,8·10-4 | 0,01 M |
| 159 к | СН3СООН | 1,8·10-5 | 0,3 M |
160. В растворе концентрации 0,1 моль/л СН3СООН α равна 1,32·10-2. При какой концентрации HNO2 ее степень диссоциации будет такой же?
161. Во сколько раз [H+] в растворе концентрации НСООН (КД=2,1·10-4) больше, чем в растворе СН3СООН (КД=1,8·10-5) той же концентрации?
162. Вычислите КД кислоты и значение рК, зная степень диссоциации α и концентрацию
| Задание | кислота | КД | концентация |
| 162 а | НСООН | 0,2 моль/л | 0,03 |
| 162 б | Н2СО3 | 0,0043 моль/л | 0,01 |
| 162 в | СН3СООН | 1 N | 0,42 |
| 162 г | СН3СООН | 0,1 N | 1,34 |
| 162 д | СН3СООН | 0,01 N | 4,25 |
163. При каком процентном содержании НСООН в растворе, где ρ=1г/мл, [H+]=8,4·10-3 моль/л?
164. Сколько воды нужно прибавить к 300 мл 0,2 М раствора СН3СООН, чтобы степень диссоциации килоты удвоилась?
165. Вычислите рН растворов, зная концентрацию вещества А:
| Задание | кислота | концентация |
| 165 а | [H+] | 10-5 |
| 165 б | КОН | 0,004 |
| 165 в | КОН | 0,01 |
166. Определите рН раствора, в 1 л которого содержится 0,1г NaOH. Диссоциацию щелочи считать полной.
167. Чему равна концентрация раствора СН3СООН, рН которого равен 5,2?
168. Как изменится рН, если вдвое разбавить водой 0,2 M раствор НСl?
169. Вычислите рН раствора слабой кислоты.
| Задание | кислота | КД | концентация, моль/л | α |
| 169 а | СН2Сl2СООН | 1,4·10-3 | 0,2 | - |
| 169 б | НА | - | 0,2 | 0,03 |
| 169 в | СН3СООН | - | 0,01 | 0,042 |
170. Рассчитайте молярную концентрацию раствора СН3СООН, рН которого равен 3(КД=1,75·10-5).
171. Вычислите рН раствора СН3СООНмассовой долей вещества 0,3 % (КД=1,75·10-5, ρ=1г/мл).
Гидролиз солей
Образующиеся при диссоциации воды ионы H+ и OH- находятся в равновесии с огромным числом недиссоциированных молекул, которые могут служить неисчерпаемым источником ионов, если указанное равновесие нарушится. Это нарушение равновесия может явиться результатом взаимодействия ионов растворенной соли с ионами воды.
При растворении многих веществ их молекулы связываются с молекулами растворителя, образуя соединения, называемые сольватами, в частном случае, когда растворителем является вода – гидратами. Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Такие вещества называются кристаллогидратами, а содержащиеся в них вода – кристаллизационной. Состав кристаллогидратов принято изображать формулами, показывающими, какое количество кристаллизационной воды содержит кристаллогидрат. Например, кристаллогидрат сульфата меди (медный купорос) CuSO4 ∙ 5H2O.
Химическое взаимодействие ионов растворенной соли с ионами H+ и OH- воды, приводящее к образованию малодиссоциированных продуктов (молекул слабодиссоциирующих кислот или оснований, ионов кислых или основных солей), называется гидролизом соли. В результате гидролиза изменяются концентрации ионов водорода и ионов гидроксила в растворе. Поэтому растворы большинства солей имеют или кислую или щелочную реакцию. С точки зрения теории гидролиза соли можно разделить на 4 группы:
I. Соли, образованные сильной кислотой и сильным основанием. Примером может служить NaCl — соль сильной кислоты HCl и сильного основания NaOH. Диссоциация соли и воды выражается уравнениями:
NaCl = Na+ + С1-
H2O = H+ + ОН-.
Ионы Na+ и Cl- не образуют с ионами H+ и OH- воды слабодиссоциирующих или труднорастворимых соединений.
В этом случае равновесие между недиссоциированными молекулами и ионами воды не нарушается. Таким образом, NaCl и другие соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; растворы их остаются нейтральными, рН практически равен семи.
II. Соли, образованные слабой кислотой и сильным основанием. Примером может служить KCN — соль слабой кислоты HCN и сильного основания KOH. Диссоциация соли и воды выражается уравнениями:
KCN = K+ + CN-
H2O = H+ + ОН-.
В этом случае ионы CN- и H+ будут взаимодействовать друг с другом, образуя молекулы слабодиссоциирующей кислоты HCN (КНСN = 7,2∙1O-10). Значит, гидролиз соли KCN происходит. При составлении ионного уравнения реакции гидролиза KCN следует учитывать, что до реакции концентрация ионов H+ в растворе ничтожна, эти ионы появляются в процессе диссоциации молекул H2O. В результате реакции образуются слабодиссоциирующие молекулы HCN и накапливается избыток свободных ионов OH-. Ионное уравнение гидролиза KCN имеет вид:
CN- + HOH = HCN + OH-.
Избыток ионов OH- означает, что раствор соли имеет щелочную реакцию и его рН>7. Продукты гидролиза — ионы OH- и молекулы HCN — в свою очередь взаимодействуют друг с другом. Поэтому гидролиз является обратимым процессом.
Прямая реакция характеризует гидролиз соли, обратная — реакцию нейтрализации. Молекулярное уравнение гидролиза KCN:
KCN + HOH = HCN + KOH.
Следует отметить некоторые особенности в отношении гидролиза солей, образованных слабодиссоциирующими многоосновными кислотами. Гидролиз этих солей протекает ступенчато. Например, при растворении в воде карбоната натрия Na2CO3 — соли слабой двухосновной кислоты взаимодействие ионов СО2- с ионами воды протекает в две стадии (ступени):
1 стадия: С0 3 2- + HOH = НСО3- + ОН-
2 стадия: HCO3- +HOH = H2CO3 + OH-
Появление в растворе избытка ионов OH- приводит к сдвигу равновесия влево, и гидролиз этой соли идет в основном только по первой ступени.
Молекулярное уравнение гидролиза Na2CO3:
Na2CO3 + HOH = NaHCO3 + NaOH
показывает, что при гидролизе соли слабой двухосновной (а также многоосновной) кислоты и сильного основания образуется кислая соль.
III. Соли, образованные сильной кислотой и слабым основанием. Примером может служить NH4Cl — сильный электролит. При диссоциации NH4Cl образуются ионы NH4+ и Cl-. В данном случае с ионами воды будут взаимодействовать лишь ионы NH4+. B результате реакции в растворе накапливается слабодиссоциирующая гидроокись аммония NH4OH и увеличивается концентрация ионов H+. Ионное уравнение гидролиза взятой соли:
NH4+ + HOH =NH4OH + H+ .
Избыток ионов H+ означает, что раствор соли NH4Cl имеет кислую реакцию и его рН<7. Гидролиз солей, образованных основаниями двух- или многовалентных металлов и сильной кислотой, протекает ступенчато. Например, при растворении хлорида цинка в воде реакция протекает в две стадии:
1 стадия: Zn2+ +HOH = ZnOH+ + H+
2 стадия: ZnOH+ + HOH = Zn(OH)2 + H+ .
Обычно гидролиз протекает только по первой ступени, т. е. катионы Zn2+ присоединяют лишь один ион OH-. Чтобы написать молекулярное уравнение гидролиза ZnCl2, нужно учесть, что, кроме ионов, непосредственно участвующих в процессе гидролиза, в растворе присутствуют еще ионы Cl-:
ZnCl2 + HOH = ZnOHCl + HCl.
Это уравнение показывает, что при гидролизе соли, образованной слабым основанием двух- или многовалентного металла и сильной кислотой, обычно получается основная соль.
IV. Соль, образованная слабой кислотой и слабым основанием. Примером может служить уксуснокислый аммоний CH3COONH4 — сильный электролит. При диссоциации его образуются ионы CH3COO- и NH4+. Оба иона соли взаимодействуют с ионами воды, образуя слабодиссоциирующие электролиты СНзСООН и NH4OH. Ионное уравнение реакции гидролиза этой соли имеет вид:
CH3COO- + NH4+ + HOH = CH3COOH +NH4OH.
Так как константы диссоциации продуктов гидролиза — NH4OH (1,79∙10-5) и CH3COOH (1,75∙10 -5) —почти одинаковы, то и связывание ионов H+ и OH- воды происходит в одинаковой степени; поэтому реакция раствора остается практически нейтральной: рН≈7.
Из уравнения реакции видно, что причиной гидролиза уксуснокислого аммония является образование двух слабодиссоциирующих электролитов — уксусной кислоты и гидроокиси аммония. Гидролиз такой соли протекает в значительной степени.
Гидролиз — процесс обратимый. Однако, если соль образована очень слабыми кислотой и основанием, то гидролиз идет практически до конца. Примером такой соли может служить сульфид алюминия Al 2 S3. Взаимодействие этой соли с водой выражается уравнением:
Al2S3 + 6H2O = 2Al (OH)3 + 3H2S.
В то же время сульфид железа гидролизу не подвергается, так как величина ПР сульфида железа Fe2S3(в отличие от Al2S3) значительно меньше, чем ПР гидрооксида железа (III).
Иногда гидролиз идет практически необратимо до промежуточного продукта гидролиза, если он достаточно малорастворим. Например, при гидролизе хлорида сурьмы (III) или висмута (III) протекают следующие реакции:
M3+ + H2O → MOH2+ + H+
MOH2+ + H2O + Cl- → M(OH)2Cl + H+
M(OH)2Cl→ MOCl↓+ H2O
Т.е. на второй ступени гидролиза образуется осадок и третья ступень практически не идет.
Образование осадка - это крайний случай гидролиза солей многозарядных катионов, а чаще в растворах таких солей образуются полиядерные молекулы за счет того, что часть гидроксоионов (например, Fe(OH)2или молекул гидроксида Fe(OH)3) вступают между собой в реакцию гидролитической полимеризации c образованием димеров, тримеров и т.д., в которых ионы металла связаны двойными гидроксомостиками. Например, в растворах солей трехвалентного висмута имеются комплексные катионы состава [Bi6(OH)12]6+.В случае двухзарядных ионов образуются одинарные гидроксомостики результате чего, например, в растворах солей бериллия, в основном, присутствуют полиядерные комплексы состава [Be3(OH)3]3+ в растворах олова (III) - [Sn2(OH)2]2+ и [Sn3(OH)4]2+. Причем, чем в большей степени протекает гидролиз, тем выше доля полиядерных молекул по сравнению с моноядерными. Усложненный состав продуктов гидролиза приводит к тому, что, например, ионы Mg2+, Cu2+, Zn2+, Pb2+ с раствором соды дают не средние соли, а гидроксокарбонаты состава Zn5(OH)6(CO3)2, Pb3(OH)2(CO3)2и т.д.
Равновесное состояние реакции гидролиза характеризуется степенью гидролиза соли.(h (%) ) – эточисло, показывающее, какая часть от общего количества растворенной соли подверглась гидролизу.
При повышении температуры усиливается диссоциация воды, т. е. повышается концентрация ионов H+ и OH-. Поэтому степень гидролиза соли с повышением температуры раствора увеличивается. Во многих случаях нагреванием удается довести гидролиз практически до конца. Например, при кипячении разбавленного раствора хлорного железа осаждается гидроксид железа.
При разбавлении раствора (увеличения количества воды) в соответствии с принципом Ле – Шателье равновесие гидролиза смещается вправо, величина h растет. Следовательно, изменяя температуру раствора и концентрацию соли в растворе, можно сместить равновесие гидролиза в том или другом направлении.
При определении глубины процесса гидролиза солей используют представление о поляризующих свойствах ионов.
Степень гидролиза солей III группы зависит от поляризующих свойств катионов. Чем больше поляризующее свойство катиона, тем выше h.
Ионы Na+, K+, Ba2+ гидролизу не подвергаются, так как имеют малые поляризующие свойства (малый заряд, относительно большой радиус) и не способны притягивать к себе ионы OH - воды.
По периоду слева направо у ионов поляризующие свойства растут, повышается способность солей к гидролизу по катиону. При рассмотрении по главным подгруппам сверху вниз поляризующие свойства ионов падают, уменьшается способность солей подвергаться гидролизу по катиону.
Степень гидролиза солей II группы тем больше, чем слабее кислота, от которой образована соль. Способность кислот к диссоциации можно сравнивать по величине КД или по поляризующим свойствам ионов. Например, из солей K2S и K2Te гидролизу в большей степени подвергается соль сероводородной кислоты, так как KH2S= 9 ∙10-8 < KH2Te=2∙10-3.
Константа гидролиза является по существу константой равновесия, характеризующей процесс гидролиза. Константа равновесия, например, первой ступени гидролиза соли, образованной многозарядным катионом слабого основания и анионом сильной кислоты
Mn+ + H2O ↔ M(OH)(n-1)+ + H+
Запишется следующим образом
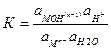
считая 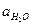 постоянной величиной, получим
постоянной величиной, получим 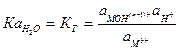
Покажем, что величина константы гидролиза определяется ионным произведением воды и константой диссоциации 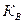 гидроксоиона
гидроксоиона
MОНк (n-k)+ ↔ M(ОН)n-k +1 + ОH-
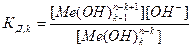
Уравнение гидролиза будет:
Me(OH)kn-k + H2O ↔ Me(OH)k+1n-k-1 + H+;
[Me(OH)k+1n-k-1]=[ H+], тогда константа гидролиза Кг будет:
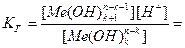
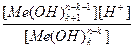 ∙
∙ 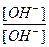 =
= 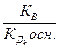 .
.
где 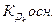 - константа диссоциации k- ой ступени диссоциации основания M(OH)k. Например, в случае водного раствора хлорида алюминия
- константа диссоциации k- ой ступени диссоциации основания M(OH)k. Например, в случае водного раствора хлорида алюминия
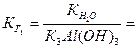
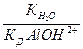
Аналогично получим формулу константы гидролиза соли, образованной многозарядным анионом слабой кислоты и катионом сильного основания
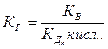 где
где 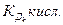 - константа k -ной ступени диссоциации слабой кислоты Hk А. Например, для водного раствора фосфата натрия
- константа k -ной ступени диссоциации слабой кислоты Hk А. Например, для водного раствора фосфата натрия
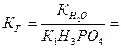
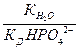
Таким же образом можно получить выражение для константы гидролиза соли, образованной катионом слабого основания и анионом слабой кислоты
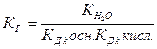
где Кn осн. - n -ая константа диссоциации основания, Кn кисл.- n-аяконстанта диссоциации кислоты.
Расчет рН растворов солей.
Для солей, содержащих однозарядные ионы слабых электролитов, можно получить формулы расчета рН их растворов.
а) В случае соли, образованной катионом слабого основания и анионом сильной кислоты
Mn+ + H2O ↔ M(OH)(n-1)+ + H+
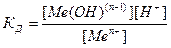
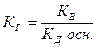 =
= 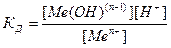 , [M(OH)(n-1) ]=[ H+] и [Mn+]=C, тогда
, [M(OH)(n-1) ]=[ H+] и [Mn+]=C, тогда
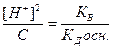 ;
; 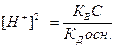 ;
; 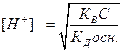 , логарифмируя это выражение и учитывая, что рН= -lg[H+], pK=- lgKД, рК В = 14, получим:
, логарифмируя это выражение и учитывая, что рН= -lg[H+], pK=- lgKД, рК В = 14, получим:
рН= ½рКВ - ½ рКосн. – ½ lgС, т.е
рН = 7- ½ рКосн. – ½ lgС, где С- молярная концентрация раствора;
б) Для соли, образованной катионом сильного основания и анионом слабой кислоты:
An- + H2O ↔ HA(n-1)- + OH-
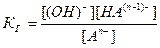 =
= 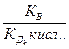 , отсюда
, отсюда 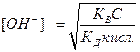 , логарифмируя данное выражение и учитывая, что рОН= -lg[ОH-], pK= - lgKД, рК В = 14 и рН=14-рОН, получим:
, логарифмируя данное выражение и учитывая, что рОН= -lg[ОH-], pK= - lgKД, рК В = 14 и рН=14-рОН, получим:
рН = 7+ ½ рКкисл. + ½ lgС,
в) В случае соли, образованной катионом слабого основания и анионом слабой кислоты
рН = 7+ ½ рКосн. – ½ рКкисл.,
т.е. значение рН раствора практически не зависит от концентрации соли, а определяется лишь соотношением констант Ккисл. и Косн. При равенстве этих констант, что имеет место, например, в случае ацетата аммония, раствор нейтрален (рН = 7).
Методика составения уравнений гидролиза.
1. На основе состава соли определяется тип гидролиза соли по: а) катиону; б) аниону; в) катиону и аниону.
2. Записывается сокращенное ионное уравнение, которое отражает взаимодействие иона соли с одной молекулой воды. В уравнении указывается стрелкой стяжение ионов.
3. По сокращенному ионному уравнению находится молекулярное уравнение. При этом следует учитывать, что двух- и более зарядные ионы гидролизуются ступенчато, образуя по 1-ой ступени кислую или основную соль. Число ступеней гидролиза равно заряду иона.
Пример 1. KCN → K+ + CN–.
K+ - ион сильного электролита KOH, гидролизу не подвергается;
CN– - однозарядный ион слабой кислоты HCN, подвергается простому гидролизу.
Сокращенное ионное уравнение:
CN- + H(OH) ↔HCN + OH-; рН>7.
Молекулярное уравнение гидролиза:
КCN + H(OH) ↔HCN + КOH;
Пример 2. Na2S → 2Na+ + S2-
Na+ - ион сильного электролита NaOH, не гидролизуется;
S2- - двухзарядный ион слабой кислоты H2S, гидролизуется ступенчато.
Сокращенные ионные уравнения:
I- я ступень S2- + H(OH) → HS- + OH-
II- я ступень HS- + H(OH) → H 2S + OH-
Молекулярные уравнения:
Na 2S + H(OH) → NaHS + NaOH
NaHS + H(OH) → H2S + NaOH, рН>7
Гидролиз идет, главным образом, по I -й ступени по следующим причинам:
1. Процесс между электролитами протекает в сторону наиболее полного связывания ионов (в сторону образования более слабого электролита). Сравнение констант диссоциации 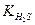 = 1,02 ∙ 10 -7 и
= 1,02 ∙ 10 -7 и 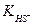 = 1,3 ∙10-13 показывает, что ионы полнее связаны в HS- . Именно ион HS- (что соответствует кислой соли NaHS) получается в результате гидролиза.
= 1,3 ∙10-13 показывает, что ионы полнее связаны в HS- . Именно ион HS- (что соответствует кислой соли NaHS) получается в результате гидролиза.
2. II–ая ступень гидролиза практически не идет вследствие накопления в растворе значительного количества ионов ОН-, способствующих протеканию процесса справа налево, согласно принципу Ле – Шателье.
Пример 3. NH4Cl → NH4+ + Cl-
Cl- - ион сильного электролита HCl, в гидролизе не участвует;
NH4+ - однозарядный ион слабого электролита NH4OH, подвергается простому гидролизу.
Сокращенное ионное уравнение:
NH4+ + H(OH) ↔ NH4OH + H+
Молекулярное уравнение гидролиза:
NH4Cl + H(OH) ↔ NH4OH + HCl.
Пример 4. Al2(SO4)3 → 2Al3+ + 3SO42-
SO42- - ион сильного электролита H2SO4, гидролизу не подвергается;
Al3+ - трехзарядный ион слабого электролита Al(OH)3, гидролизуется ступенчато.
Сокращенные ионные уравнения:
I- я ступень Al3+ + H(OH) ↔ AlOH2+ + H+
II- я ступень AlOH2+ + H(OH) ↔ Al(OH)2+ + H+
III- я ступень Al(OH)2+ + H(OH) ↔ Al(OH)3 + H+, рН<7
Для написания молекулярного уравнения основные ионы AlOH2+ и Al(OH)2+ нужно комбинировать с ионами SO42- так, чтобы получились электронейтральные молекулы: AlOHSO4, [Al(OH)2]2SO4, затем подобрать к уравнению коэффициенты.
Молекулярные уравнения:
I- я ступень Al2(SO4)3 + 2H2O ↔ 2Al(OH)SO4 + H2SO4
II- я ступень 2Al(OH)SO4 + 2H2O ↔[Al(OH)2]2 SO4 +H2SO4
III- я ступень [Al(OH)2]2SO4 + 2H2O ↔ 2Al(OH)3 + H2SO4
Процесс ограничивается I-ой и частично II-ой ступенями, так как:
- AlOH2+ более слабый электролит, чем Al(OH)2+ и тем более Al(OH)3.
- Накопление значительных количеств ионов Н+ способствует протеканию процесса справо налево.
Пример 5. CH3COONH4 → CH3COO- + NH4+
CH3COO- - анион от слабой кислоты CH3COOH;
NH4+ - катион от слабого основания NH4OH. Гидролиз идет по катиону и по аниону.
Ионное уравнение гидролиза:
NH4+ + CH3COO- + H(OH) ↔ NH4OH + CH3COOH
Молекулярное уравнение:
CH3COONH4 + H2O ↔ NH4OH + CH3COOH
Силы образовавшихся электролитов примерно одинаковы:
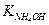 ≈
≈ 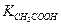 : [OH-] ≈ [H+] и рН≈7.
: [OH-] ≈ [H+] и рН≈7.
Данная соль гидролизуется значительно, так как оба продукта гидролиза NH4OH и CH3COOH – слабые электролиты.
Пример 6. Cr2S3 → 2Cr3+ + 3S2-
Cr3+ и S2- - ионы от очень слабых электролитов Cr(OH)3 и H2S. Кроме того, Cr(OH)3 - малорастворимое соединение, а H2S – летучее.
Эта соль в водном растворе полностью гидролизуется:
2Cr3+ + 3S2- + 6H(OH) → 2Cr(OH)3 ↓+ 3H2S↑
Молекулярное уравнение:
Cr2S3 + 6H2O → Cr(OH)3 + 3H2S.
Так как продукты выводятся из сферы реакции – процесс идет необратимо, что подчеркивается стрелкой в уравнении.
Такие соли, как Al2S3, Al2(CO3)3, Fe2(CO3)3, могут существовать только в кристаллах, а в растворе подвергаются полному гидролизу. В таблицах растворимости против этих солей стоит прочерк, что означает необратимое разложение данных солей водой.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
173. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СrС13. Каждая из взятых солей гидролизуется необратимо, до конца с образованием соответствующих оснований и кислоты.
174. К раствору A12(SО4)3 добавили следующие вещества:
a) H2SО4; б) КОН; в) Na2SО3; г) ZnSО4.
175. В каких случаях гидролиз A12(SО4)3 усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза этих солей.
176. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и СгСl3. Каждая из взятых солей гидролизуется необратимо, до конца с образованием соответствующих оснований и кислоты.
177. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
178. При смешивании растворов A12(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо, до конца, с образованием соответствующего основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза.
179. Какие из солей: NaCl, Cr2(SO4)3, CuCl2, KBr, Na3PO4 – подвергаются гидролизу, и какова его форма (простая, ступенчатая, полная). Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
180. Какие из солей: MnCl2, K2CO3, Ni(NO3)2, KCl, KClO4 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
181. Что называется степенью гидролиза? Как влияет повышение температуры на степень гидролиза?
182. Какие из солей: Zn(NO3)2, CuSO4, CH3COOK, Na2SO4, K2Se - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
183. Какие из солей: Al2(SO4)3, Na2SO3, KBr, K2SeO4, CoCl2 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
184. Какие из солей: NaNO3, CrCl3, KCl, ZnSO4, Al2(CO3)3 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
185. Какие из солей: Fe2(SO4)3, FeCl2, KNO3, NaJ, NaNO3, Al2S3 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
186. Какие из солей: NiCl2, K3PO4, KCl, Cr2S3, MnSO4 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
187. Какие из солей: Al(NO3)3, CaSO4, NaClO, BaCl2, K2AsO4 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
188. Какие из солей: CH3COONH4, Pb(NO3)2, Pb2S, KCl, CuCl2, CdSO4 - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
189. Какие из солей: NH4Cl, Ba(NO3)2, NaClO4,Cr2S3, K2S, NaCl - подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
190. Какие из солей: BiCl3, Sn(NO3)2, NaBr, Na3AsO4, Sr(NO3)2, Na2S, KClO4 – подвергаются гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
191. Какие из солей: RbCl, NaCN, Fe2(CO3)3, KNO3, AlCl3, HCl – подвергаются к гидролизу и какому гидролизу (простому, ступенчатому, полному)? Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
192. Какие из солей: NH4NO3, K2SiO3, Cu(NO3)2, CsNO3, NaF – подвергаются гидролизу и какому гидролизу (простому, ступенчатому, полному). Составьте молекулярные и ионные уравнения реакций. Какое значение рН имеют растворы этих солей?
