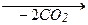Получение непредельных кислот
1.Введение карбоксильной группы в олефин:
{\displaystyle {\mathsf {CH_{2}{=}CHCH_{3}+Cl_{2}{\xrightarrow[{}]{450C,-HCl}}CH_{2}{=}CHCH_{2}Cl{\xrightarrow[{}]{+KCN,-KCl}}CH_{2}{=}CHCH_{2}CN{\xrightarrow[{}]{+H_{2}O,-NH_{3}}}CH_{2}CHCH_{2}COOH}}}2. Исходят из предельной кислоты и переводят её в ненасыщенную
Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:

Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.
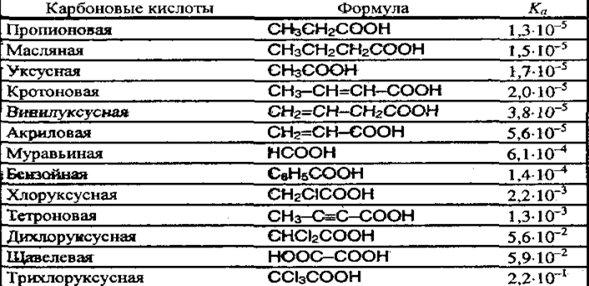
1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:
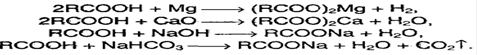
Карбоновые кислоты – слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:

2. Образование функциональных производных карбоновых кислот:
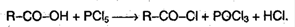
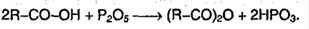
3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты – реакция этерификации:
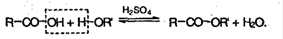
4. Образование амидов, нитрилов:
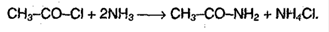
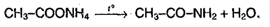
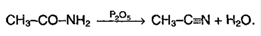
3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:
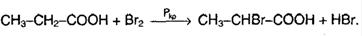
4. Реакция присоединения.
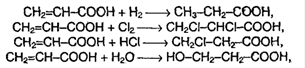
5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:
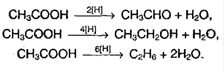
Исключение: муравьиная кислота:
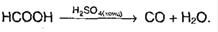
6. Реакция серебряного зеркала:
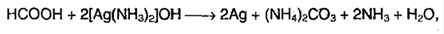
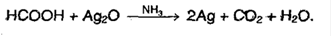
7. Окисляется хлором
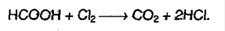
8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:
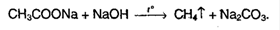
К производным кислот относятся галогенангидриды, ангидриды, кетены, сложные эфиры, амиды, азиды, нитрилы и др. Общим свойством всех этих соединений является наличие электронодефицитного атома углерода, что является причиной их способности к ацилированию нуклеофильных субстратов (аминов, спиртов и др.). При этом происходит превращение одних производных карбоновых кислот в другие.
Производные карбоновых кислот, как и сами кислоты, способны вступать в реакции нуклеофильного замещения у sp2--гибридизован- ного атома углерода с образованием других функциональных производных. Механизм такого замещения отличается от рассмотренного выше механизма нуклеофильного замещения у sp3--гибридизованного атома углерода в галогеноалканах и спиртах (см. 4.3).
Тетраэдрический механизм нуклеофильного замещения.Сначала нуклеофил присоединяется к атому углерода группы С=О с образованием нестабильного промежуточного аниона (интермедиата). Механизм реакции называют тетраэдрическим, так как атом углерода при этом переходит из sp2- в sр3-гибридное состояние и принимает тетраэдрическую конфигурацию.
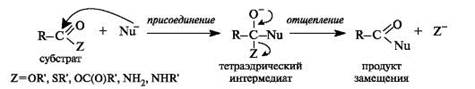
На второй стадии от интермедиата отщепляется частица Z и атом углерода вновь становится sp2-гибридизованным. Таким образом, эта реакция замещения включает стадии присоединения и отщепления.
По такому механизму реакция протекает при наличии достаточно сильного нуклеофила и хорошей уходящей группы Z, напри- мер, в случае щелочного гидролиза сложных эфиров и других функциональных производных карбоновых кислот. Легкость нуклеофильной атаки зависит от величины частичного положительного заряда δ+ на атоме углерода карбонильной группы. В функциональных производных карбоновых кислот он увеличивается с ростом -I-эффекта заместителя Z и уменьшается с увеличением его M-эффекта. В результате этих эффектов величина заряда и, следовательно, способность подвергаться нуклеофильной атаке в рассматриваемых соединениях уменьшаются в приведенной ниже последовательности. К этому же выводу приводит и анализ стабильности уходящих групп Z-, которые выделены цветом (см. 4.2.1).
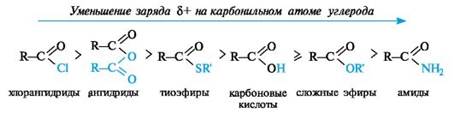
Производные карбоновых кислот по сравнению с альдегидами и кетонами труднее подвергаются нуклеофильной атаке, так как электрофильность карбонильного атома углерода обычно снижается
за счет +M-эффекта заместителя Z. По этой причине в нуклеофильных реакциях функциональных производных карбоновых кислот часто оказывается необходимым кислотный катализ путем протонирования атома кислорода карбонильной группы. Примером такой активации служит уже рассмотренная реакция этерификации (см. 6.1.3).
В результате взаимодействия карбоновых кислот и их функциональных производных со спиртами или аминами в молекулы этих соединений вводится ацильный остаток. По отношению к таким реакциям используют общее название - реакции ацилирования. С этой позиции реакцию этерификации можно рассматривать как ацилирование молекулы спирта.
Функциональные производные кислот обладают разной реакционной способностью в реакциях ацилирования. Наиболее активны хлорангидриды и ангидриды; из них можно получать практически любые производные кислот. Сами кислоты и сложные эфиры (с остатками алифатических спиртов) - значительно менее активные ацилирующие агенты. Реакции замещения с их участием проводятся в присутствии катализаторов. Амиды вступают в реакции ацилирования еще труднее, чем кислоты и сложные эфиры.
Соли карбоновых кислот ацилирующей способностью не обладают, поскольку анион карбоновой кислоты не может быть атакован отрицательно заряженным нуклеофилом или молекулой с неподеленной парой электронов.
2. Двух- и трех-атомные фенолы. Номенклатура, химические свойства. Двойственная реакционная способность резорцина и флороглюцина, причина. Привести примеры химических реакций таутомерных форм этих соединений
Фенолами называются производные ароматических углеводородов, получающиеся в результате замещения одного или нескольких атомов водорода в ядре гидроксильными группами.
Общая рациональная формула фенолов очень сходна с общей рациональной формулой спиртов. Однако они отличаются от спиртов по своим свойствам.
Кислотные свойства фенола выражены ярче, чем у спиртов. Это объясняется тем, что свободная электронная пара атома кислорода в феноле оттянута к ядру (+М-эффект), особенно электронная плотность повышается в местах 2, 4, 6 и способствует протеканию реакций электрофильного замещения в данных положениях.
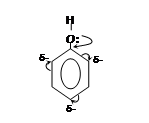 |
Бензольное кольцо, в свою очередь, вызывает смещение электронной плотности от атома кислорода к ядру, что приводит к увеличению положительного заряда на кислороде, а, следовательно, к увеличению кислотных свойств фенола (так, фенол, в отличие от спиртов, реагирует со щелочами).
|
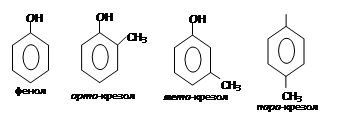
При замещении в ядре ароматического углеводорода двух гидроксилов получаются двухатомные фенолы С6Н4(ОН)2, а при введении трех гидроксилов – трехатомные фенолы С6Н3(ОН)3.
|
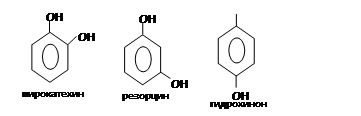
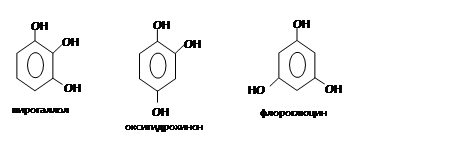
Химические свойства:
Общая формула фенолов очень сходна с общей рациональной формулой спиртов. Однако они отличаются от спиртов по своим свойствам.
Кислотные свойства фенола выражены ярче, чем у спиртов.
– взаимодействие с металлами:
Аналогично спиртам фенолы реагируют с металлами, при этом образуются феноляты:
2 С6Н5ОН + 2Na → 2C6H5ONa +H2↑.
фенолят натрия
Образовавшиеся феноляты по своим свойствам отличаются от алкоголятов, так, они могут существовать в водных растворах не разлагаясь;
– взаимодействие со щелочами:
Всем фенолам присущи слабокислые свойства (фенол называют карболовой кислотой), что проявляется в их способности растворяться в щелочах с образованием фенолятов:
С6Н5ОН + NaОН → C6H5ONa +H2О.
Спирты практически не реагируют со щелочами, т. е. кислотными свойствами не обладают. Алгоколяты (аналогичные по формуле фенолятам) получаются из спиртов только при действии свободных щелочных и щелочноземельных металлов, например, натрия:
2С2Н5ОН + 2Na → 2C2H5ONa +H2↑;
этилат натрия
–  образование простых эфиров:
образование простых эфиров:
Фенолы, подобно спиртам, способны образовыватьсоединения типа простых эфиров. Практически для получения простых эфиров фенолов на феноляты действуют галогеналкилами или галогенарилами:
С6Н5О Na + I C2H5 → C6H5−O−C2H5 + NaI;
 С6Н5О Na + Br C6H5 → C6H5−O−C6H5 + NaBr.
С6Н5О Na + Br C6H5 → C6H5−O−C6H5 + NaBr.
– образование сложных эфиров:
Подобно спиртам, фенолы могут давать соединения типа сложных эфиров. Для получения которых на феноляты действуют галогенангидридами кислот, например:
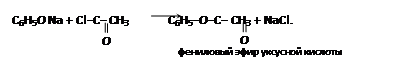
В целом гидроксильная группа фенолов значительно менее подвижна, чем гидроксил спиртов. Получение эфиров даже с хлорангидридами карбоновых кислот несколько затруднено, с кислотами реакция вообще не идет;
– реакция окрашивания хлорным железом (качественная реакция на фенолы:
Все фенолы дают с хлоридам железа (III) окрашивание; одноатомные фенолы обычно дают окрашивание фиолетового или синего цвета;
– галогенирование (обесцвечиваное бромной воды) – качественная реакция на фенол:
Остаток бензола в фенолах влияет на гидроксильную группу, сообщая ей кислотные свойства. Однако и гидроксил, введенный в молекулу бензола, увеличивает подвижность атомов водорода в бензольном ядре. В результате атомы водорода в ядре молекулы фенола очень легко замещаются – гораздо легче, чем в ароматических углеводородах (особенно в орто- и пара-положениях).
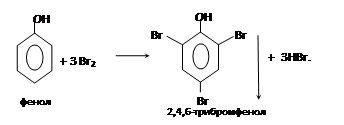
– взаимодействие с азотной кислотой:
Фенолы очень легко нитруются. Так, при действии даже очень разбавленной азотной кислоты получается смесь орто- и пара-нитрофенола:
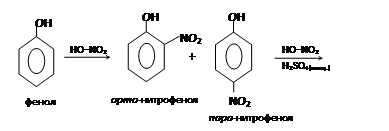
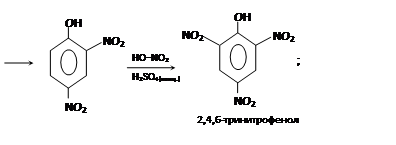
– сульфирование:
При сульфировании фенола получаются фенолсульфоновые кислоты, причем соотношение орто- и пара-изомеров определяется температурой реакции. При температурах выше 100 °С орто-изомер перегруппировывается в пара-изомер:
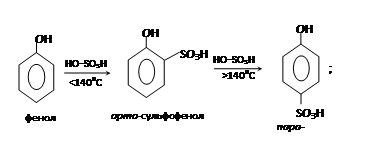
– взаимодействие с формальдегидом с образованием фенолформальдегидной смолы:
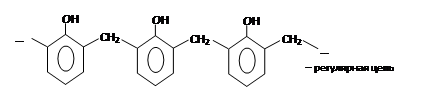
Получение фенолов:
– из каменноугольного дегтя:
Получение из каменноугольного дегтя – важнейший технический способ получения фенолов. Фракции дегтя обрабатываются щелочами. Фенолы, хорошо растворимые в водных растворах щелочей с образованием фенолятов, легко отделяются при этом от углеводородов дегтя, которые в воде и водных растворах щелочей не растворяются. Полученные щелочные растворы, содержащие феноляты, обрабатывают серной кислотой, которая разлагает феноляты; в результате опять выделяются фенолы:
С6Н5ОNa + H2SO4 → NaHSO4 + C6H5OH;
– из галогенбензолов:
При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при обработке которого кислотой образуется фенол:
С6Н5Cl + NaOH → C6H5OH + NaCl;
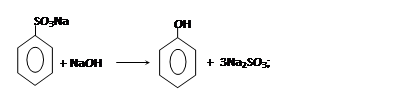
– из солей сульфокислот:
При сплавлении солей сульфокислот со щелочами образуется фенол и сульфит натрия:
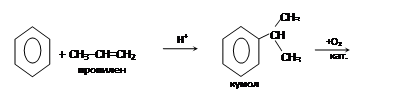
– кумольный (промышленный метод:
таутомерия 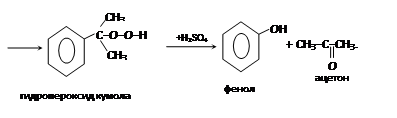
До недавнего времени было общепринятым считать таутомерию единственной причиной двойственной реакционной способности органических веществ. Это положение схематически можно выразить следующим образом: если вещество А дает два ряда производных (А' и В'), то оно таутомерно веществу В, и производное В' образуется не из А, а из В:

Однако во многих случаях никакими из существующих методов не удается обнаружить наличие второго таутомера. Это обстоятельство послужило причиной возникновения понятия псев-
домерии. Псевдомерными называют такие таутомерные смеси, в которых концентрация одного из таутомеров (например, В) «исчезающе мала», но он обладает значительно более высокой реакционной способностью, чем А, и производное B'все-таки образуется из В, а не из А. Однако М. И. Кабачник показал, что в случае сильно смещенного в сторону А равновесия

образование В' из В не всегда возможно.
Превращение равновесной смеси

в В' по схеме псевдомерного превращения
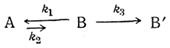
должно идти медленнее, чем прямое превращение А→В' при той же начальной концентрации [А]. Если константа таутомерного равновесия
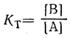
весьма мала (ниже 10–10), то скорость образования В' по схеме В→В' вследствие ничтожной концентрации [В] будет крайне низкой. Образование В' из В могло бы протекать с измеримой скоростью только в том случае, если бы константаk3реакции В→В' была необычайно велика, например порядка
1010—1012 моль–1 ∙ сек–1 для мономолекулярных превращений и 1010—1011 моль–1 ∙ сек–1 для бимолекулярных. Однако столь большие константы скорости реакций в органической химии возможны только для ионов или радикалов, но не для молекул. Следовательно, при таутомерных равновесиях, сильно смещенных в сторону А (KT<10–10), практически В' не может получаться из В и возможно образование В'только непосредственно из А.
Если же равновесие А↔В не сильно смещено (нижний предел KT порядка 10–6—10–8), то оно является не псевдомерным, а обыкновенным таутомерным равновесием, когда присутствие формы В может быть доказано и ее концентрация измерена. Следовательно, не остается места для псевдомерии как явления, обусловливающего двойственную реакционную способность за счет необычайно высокой реакционной способности таутомера, содержащегося в «исчезающе малой» концентрации.
Если и существуют такие, столь сильно смещенные равновесия, что мы не можем обнаружить в них присутствие второго таутомера из-за недостаточной точности существующих методов, то во всяком случае этот второй таутомер, присутствующий в столь ничтожной концентрации, к двойственной реакционной способности вещества практически не имеет никакого отношения. В действительности двойственная реакционная способность таутомерных веществ с сильно смещенным равновесием обусловлена параллельным течением реакций по двум возможным направлениям: без переноса реакционного центра и с переносом реакционного центра. Оба ряда производных А' и В' возникают не из В, а из А:
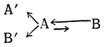
Примерами реакций подобного рода могут служить реакции альдоксимов и кетоксимов, изатина, амидов карбоновых кислот, а также α-аминопиридина.
Таким образом, явление двойственной реакционной способности шире явления таутомерии. Двойственная реакционная способность возможна как вследствие таутомерии, так ивследствие переноса реакционного центра.
Билет № 14
1. Дикарбоновые кислоты. Химические свойства (отношение к нагреванию 1,2-, 1,3-, 1,4-, 1,5- и 1,6-дикарбоновых кислот), получение производных кислот. Синтез на основе малонового эфира.
Двухосновные карбоновые кислоты (или дикарбоновые кислоты) — это карбоновые кислоты, содержащие две карбоксильные группы —COOH, с общей формулой HOOC—R—COOH, где R — любой двухвалентный органический радикал
Дикарбоновые кислоты проявляют те же химические свойства, что и монокарбоновые — эти свойства обусловлены наличием карбоксильной группы:
диссоциация в водных растворах:первая стадия (Ka1):
HOOC—X—COOH → HOOC—X—COO− + H+
Дикарбоновые кислоты — более сильные кислоты по первой стадии диссоциации, чем соответствующие монокарбоновые: во-первых, из-за статистического фактора (две карбоксильные группы в молекуле), во-вторых, из-за взаимного влияния этих групп (если они находятся недалеко или связаны цепью кратных связей);вторая стадия (Ka2):
HOOC—X—COO− → −OOC—X—COO− + H+
На второй стадии эти кислоты становятся более слабыми, чем монокарбоновые кислоты (исключение — щавелевая кислота). Отделение катиона водорода второй карбоксильной группы происходит труднее, чем первой, так как требуется больше энергии, чтобы отделить H+ от аниона с зарядом −2, чем при отделении от аниона с зарядом −1;
образование солей: в отличие от монокарбоновых кислот, дикарбоновые способны образовывать кислые соли;
образование галогенангидридов.
В то же время есть существенные различия, обусловленные наличием второй карбоксильной группы:
склонность к образованию хелатов;
образование некоторыми кислотами циклических ангидридов;
способность образовывать полимеры в реакции с другими полифункциональными соединениями.
Номенклатура
Для карбоновых кислот характерны тривиальные названия, поэтому используют названия природных продуктов, из которых они получены: щавелевая кислота — щавель, янтарная — из янтаря. По номенклатуре ИЮПАК двухосновные кислоты имеют окончания «-диовая» или «-дикарбоновая». Пример: щавелевая — этандиовая кислота, малоновая — пропандиовая или метандикарбоновая.
Способы получения
1) Окисление спиртов, альдегидов, кетонов, например:
НOCН2-(CH2)n-СН2OH 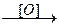 НOOC-(CH2)n-СOOH
НOOC-(CH2)n-СOOH
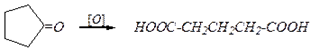
2) гидролиз ацильных производных, гидратация нитрилов и другие реакции по ацильной группе (для получения производных кислот), например:
Н5С2OOC-(CH2)n-СOOC2H5 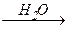 НOOC-(CH2)n-СOOH
НOOC-(CH2)n-СOOH
NºC-(CH2)n-CºN 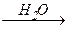 НOOC-(CH2)n-СOOH
НOOC-(CH2)n-СOOH
3) металлорганический синтез — карбоксилирование реактивов Гриньяра или литийорганических соединений, например:
ClMg-(CH2)n-MgCl 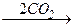 ClMg-OOC-(CH2)n-СOO-MgCl
ClMg-OOC-(CH2)n-СOO-MgCl 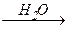
® НOOC-(CH2)n-СOOH
4) Электролиз щелочных растворов моноэфиров дикарбоновых кислот:
2 ROOC-(CH2)n-СOO- 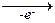 2 ROOC-(CH2)n-СOO×
2 ROOC-(CH2)n-СOO×