Электролиз солей непредельных карбоновых кислот. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы
Физические свойства
Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов.
Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Характеристики связей в алкинах:
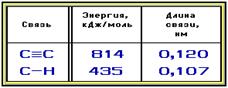
Некоторые отличия в свойствах алкинов и алканов определяются следующими факторами.
1.p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения к алкинам протекают медленнее, чем к алкенам.
2.p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения.
3.Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. Это объясняется различным вкладом в гибридизованное состояние s-орбитали, которая более прочно, чем р-АО, удерживает электроны (сравните форму и энергию s- и р-АО). Доля s-АО в sp3-состоянии составляет 25%, в sp2- 33%, а в sp- 50%. Чем больше вклад s-АО, тем выше способность атома удерживать внешние электроны, т.е. его электроотрицательность. Повышенная полярность связи С(sp)-Н приводит к возможности ее гетеролитического разрыва с отщеплением протона Н+. Таким образом, алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с металлами, образовывать соли.
Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала. Алкины хорошо растворимы в неполярных органических растворителях.
Получение
1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr - СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
4.
| С2Н5ОН | |||
| СН3 - СВr2 - СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
Электролиз солей непредельных карбоновых кислот
В 1864 году Кекуле получил ацетилен электролизом фумарата и малеата натрия:
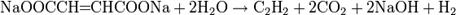
Аналогично получается ацетилен и из акрилата натрия.
Этот метод носит чисто историческое значение.
3. Гомологи ацетилена можно также получать, действуя галогеналканами на соли ацетиленовых углеводородов (ацетилениды):
CH3 - C ≡ CNa + I-R → CHg - C ≡ C-R + NaI.
Эта реакция представляет собой пример нуклеофильного замещения, а нуклеофилом в ней является ацетиленидный карбанион
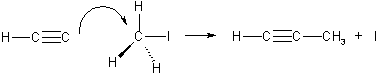
4. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
| 1500°С | ||
| 2СН4 | → | CH ≡ NCH + ЗН2 |
или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
| 1200°С | 1200°С | ||||
| C2H6 | → | C2H2 + 2Н2, | 2С3Н8 | → | ЗС2Н2 + 5Н2 |
Сырьем в этих способах служит природный газ или нефть.
5.В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
