Применение фторидов ксенона рассмотрено в следующем разделе
18.3.3.2. Фториды других элементов 18-й группы
У благородных газов, более легких, чем ксенон, известен лишь дифторид криптона KrF2 и ряд его аддуктов.
Радон должен был бы реагировать интенсивнее, чем ксенон, благодаря более «мягкой» электронной оболочке. Однако синтез соединений радона осложнен его высокой радиоактивностью, а следовательно, необходимостью использовать очень небольшие количества изотопа Rn. При этом происходят большие потери из-за адсорбции радона и его производных на внутренних поверхностях реакторов, что серьезно осложняет идентификацию полученных фторидов.
Дифторид криптона KrF2 - бесцветное летучее кристаллическое вещество (давление пара при 00С = 30 мм рт. ст.). Длительное хранение в контейнерах из тефлона или никеля возможно только при низкой температуре, гак как при комнатной температуре происходит разложение KrF2.
Кристаллы KrF2 построены из линейных фрагментов, как в случае XeF2. Линейными являются молекулы дифторида криптона и в парах.
При самопроизвольной диссоциации KrF2 выделяется атомный фтор. Это делает KrF2 одним из самых сильных фторокислителей: средняя энергия связи Кr-F существенно меньше энергии связи Хе-F в рассмотренных выше фторидах и меньше энергии связи F-F в молекуле F2:
KrF2 < F2 < XeF6 < XeF4 < XeF2.
Взаимодействуя с большинством соединений, KrF2 воспламеняется; выше 80С он разлагает воду со взрывом.
Может показаться, что KrF2, слишком реакционноспособен, чтобы его можно было практически использовать. Однако, если вести синтез при низкой температуре и разбавлять KrF2 каким-либо инертным веществом, например жидким безводным (HF)n, с его помощью можно получить термически неустойчивые фториды, синтез которых в иных условиях неосуществим. Примером может служить синтез MnF4 высокой чистоты (действием на дифторид марганца раствором KrF2 в HF) и синтез AgF3, (действием на Ag пли AgF раствором дифторида криптона в HF).
Долгое время попытки получения соединений криптона (прежде всего фторидов) были безуспешными. Так и не удалось зафиксировать взаимодействие Кr и F, при нагревании их смеси до 4000С, а также при замене F2 на такие доноры атомного фтора, как RhF6 и O2F2. К успеху привела только активация реагентов физическими методами (облучение светом различных энергии, заряженными частицами, электрическим разрядом).
Впервые KrF2 был синтезирован в очень сложных условиях: твердую (т.е. охлажденную до очень низких температур) смесь [Кr]:[F2]:[Аr] = 70:1:220, нанесенную на пластину CsF, облучали при 20 К УФ-светом (3 ч), а также электронами и α-частицами с энергией 40 МэВ при -1400С. За 1 ч был получен 1 г KrF2.
Сейчас KrF2 синтезируют, действуя на смесь [Kr]:[F2] = 1:5 электрическим разрядом (сила тока 30 мА, напряжение 500 - 1000 В) при температуре -1960С.
Применение фторидов Хе и Кr очень расширяет возможности неорганического и органического синтеза для получения высших фторидов элементов-металлов и неметаллов в мягких условиях и для контролируемого фторирования органических соединений. Как видно из приведенного ряда
KrF2 > O2F2 > RuF6 > F2 > XeF6 > CIF5 ≈ XeF4 > XeF2,
окислительная активность фторидов криптона и ксенона охватывает широкий интервал изменения этой активности. Используя в синтезе тот или иной фторид благородных газов, можно варьировать активность фторокислителей для получения продуктов заданного состава. Важно отметить, что фториды Хе можно использовать при проведении окисления в водных растворах, т.е. в условиях, при которых F2 применить нельзя. Возможно также применение XeF2 и XeF4 в качестве источников атомного фтора при работе фтороводородных химических лазеров.
18.3.3.3. Оксофториды
Благородные газы образуют оксофториды различного состава. При комнатной температуре это твердые (XeOF2. XeO2F2) или жидкие (XeOF4, XeO3F2) вещества. Все они быстро гидролизуются и, возможно, поэтому взрывоопасны. Получают их осторожным гидролизом фторидов ксенона, взаимодействием его кислород- и фторпроизводных и другими способами, например:
XеF4 + Н2О 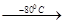 XeOF2 + 2НF.
XeOF2 + 2НF.
XeF6 + Н2О = XeOF4 + 2HF,
XeF6 + 2POF3 = XeO2F2 + 2PF5.
XeF6 + XeO4 = XeO3F2 + XeOF4.
