III. Взаимодействие с водой
ОБЩИЕ СВОЙСТВА
Положение металлов в периодической таблице
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Общие свойства металлов
Виды кристаллических решеток
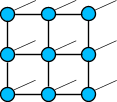 | 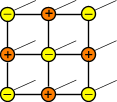 | 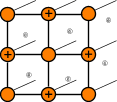 |
| атомная | ионная | металлическая |
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
Общие физические свойства
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
1) Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe® уменьшается.
2) Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность.
Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe® уменьшается.
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē ® Men+
I. Реакции с неметаллами
1) С кислородом:
2Mg0 + O2 ® 2Mg+2 O
2) С серой:
Hg0 + S ® Hg+2 S
3) С галогенами:
Ni + Cl2 –t°® Ni+2Cl2
4) С азотом:
3Ca0 + N2 –t°® Ca3+2N2
5) С фосфором:
3Ca0 + 2P –t°® Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li0 + H2 ® 2Li+1H
Ca0 + H2 ® Ca+2H2
II. Реакции с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg0 + 2HCl ® Mg+2Cl2 + H20
(Mg0 + 2H+ ® Mg2++ H20)
2Al0+ 6HCl ® 2AlCl3 + 3H20
(2Al0 + 6H+ ® 2Al3+ + 3H20)
6Na0 + 2H3PO4 ® 2Na3+1PO4 + 3H2
(6Na0 + 6H+ ® 6Na+ + 3H20)
Восстановление металлами кислот-окислителей смотри в разделах: "окислительно-восстановительные реакции", "серная кислота", "азотная кислота".
III. Взаимодействие с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 + 2H2O ® 2Na+1OH + H20
(2Na0 + 2H2O ® 2Na1+ + 2OH1- + H20)
Ca0 + 2H2O ® Ca+2(OH)2 + H20
(Ca0 + 2H2O ® Ca2+ + 2OH1- + H20)
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O –t°® Zn+2O + H02
3) Неактивные (Au, Ag, Pt) - не реагируют.
4) Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu0 + Hg+2Cl2 ® Hg0 + Cu+2Cl2
(Cu0 + Hg2+ ® Cu2+ + Hg0)
Fe0 + Cu+2SO4 ® Cu0 + Fe+2SO4
(Fe0 + Cu2+ ® Cu0 + Fe2+)
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Общая характеристика
Свойства щелочных металлов
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | ПИ эВ | Атомный радиус, нм | Степень окисления |
| Литий Li | [He] 2s1 | 0,531 | 180,5 | 0,97 | 5,39 | 0,157 | +1 | ||
| Натрий Na | [Ne]3s1 | 0,97 | 97,9 | 882,9 | 1,01 | 5,138 | 0,191 | +1 | |
| Калий K | [Ar] 4s1 | 0,859 | 63,65 | 0,91 | 4,339 | 0,236 | +1 | ||
| Рубидий Rb | [Kr] 5s1 | 1.53 | 38,4 | 0,89 | 4,176 | 0,253 | +1 | ||
| Цезий Cs | [Xe] 6s1 | 1,88 | 28.4 | 0,86 | 3,893 | 0,274 | +1 | ||
| Франций Fr | [Rn] 7s1 | – | – | – | – | – | – | +1 |
Физические свойства
Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.
Низкий потенциал ионизации, который уменьшается с увеличением атомного номера.
Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла.
Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.
Нахождение в природе
Li
Li2O • Al2O3 • 4SiO2 – сподумен
Na
NaCl – каменная соль
Na2SO4 • 10H2O – глауберова соль (мирабилит)
NaNO3 – чилийская селитра
K
KCl • NaCl – сильвинит
KCl • MgCl2 • 6H2O – карналлит
K2O • Al2O3 • 6SiO2 – полевой шпат (ортоклаз)
Химические свойства
Все щелочные металлы - очень сильные восстановители, в соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs®.
Все соединения щелочных металлов имеют ионный характер.
Практически все соли растворимы в воде.
1. Активно взаимодействуют с водой:
2Na + 2H2O ® 2NaOH + H2
2Li + 2H2O ® 2LiOH + H2
2. Реакция с кислотами:
2Na + 2HCl ® 2NaCl + H2
3. Реакция с кислородом:
4Li + O2 ® 2Li2O(оксид лития)
2Na + O2 ® Na2O2(пероксид натрия)
K + O2 ® KO2(надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
4. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 ® 2LiCl(галогениды)
2Na + S ® Na2S(сульфиды)
2Na + H2 ® 2NaH(гидриды)
6Li + N2 ® 2Li3N(нитриды)
2Li + 2C ® 2Li2C2(карбиды)
Реагируют со спиртами и галогенопроизводными углеводородов (смотри "Органическую химию")
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Оксиды щелочных металлов – R2O
Получение
Окислением металла получается только оксид лития
4Li + O2 ® 2Li2O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na2O2 + 2Na ® 2Na2O
KO2 + 3K ® 2K2O
Химические свойства
Типичные основные оксиды.
Реагируют с водой, кислотными оксидами и кислотами:
Li2O + H2O ® 2LiOH
Na2O + SO3 ® Na2SO4
K2O + 2HNO3 ® 2KNO3 + H2O
Пероксид натрия Na2O2
Получение
2Na + O2 ® Na2O2
Химические свойства
1. Сильный окислитель:
2NaI + Na2O2 + 2H2SO4 ® I2 + 2Na2SO4 + 2H2O
2Na2O2 + 2CO2 ® 2Na2CO3 + O2
2. Разлагается водой:
Na2O2 + 2H2O ® 2NaOH + H2O2
Надпероксид калия KO2
Получение
K + O2 ® KO2
Химические свойства
1. Сильный окислитель:
4KO2 + 2CO2 ® 2K2CO3 + 3O2
2. Разлагается водой:
2KO2 + 2H2O ® 2KOH + H2O2 + O2
Гидроксиды щелочных металлов – ROH
Белые, кристаллические вещества, гигроскопичны; хорошо растворимы в воде (с выделением тепла). В водных растворах нацело диссоциированы.
Получение
1. Электролиз растворов хлоридов:
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
катод: 2H+ + 2ē ® H02
анод: 2Cl- – 2ē ® Cl02
2. Обменные реакции между солью и основанием:
K2CO3 + Ca(OH)2 ® CaCO3¯ + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2Li + 2H2O ® 2LiOH + H2
Li2O + H2O ® 2LiOH
Na2O2 + 2H2O ® 2NaOH + H2O2
Химические свойства
R–OH – сильные основания (щелочи) (основность увеличивается в ряду LiOH – NaOH – KOH – RbOH –CsOH); реагируют с кислотными оксидами и кислотами:
2NaOH + CO2 ® Na2CO3 + H2O
LiOH + HCl ® LiCl + H2O
При сплавлении NaOH с ацетатом натрия образуется метан:
NaOH + CH3COONa –t°® Na2CO3 + CH4
