Классификация методов объемного анализа.
В зависимости от типа химической реакции, лежащей в основе титрования, различают следующие методы объемного анализа:
а) метод нейтрализации – в качестве стандартных растворов используют растворы сильных кислот и оснований (щелочей) – метод ацидиметрического или алкалиметрического титрования соответственно;
б) метод окисления – восстановления – в качестве стандартных используют растворы окислителей и/или восстановителей; методы окислительно-восстановительного титрования называют по названию реагента: метод перманганатометрии, в котором стандартным раствором реагента является раствор перманганата калия; дихроматометрии – стандартный раствор дихромата калия и др.;
в) метод осаждения;
г) метод комплексообразования, частным случаем которого является метод комплексонометрии.
По способу выполнения титрования различают методы прямого и обратного титрования, а также метод титрования заместителя:
a)метод прямого титрования состоит в непосредственном титровании аликвотной части исследуемого раствора, содержащего определяемый ион, стандартным раствором реагента. Например, титрование сильных кислот, щелочей, гидролизующихся солей (карбоната натрия) в присутствии кислотно-основных индикаторов; титрование соли железа (II) раствором перманганата калия и др. В точке конца титрования выполняется закон эквивалентов, который лежит в основе всех расчетов: определяемое вещество (ион), содержащееся в аликвотной части, и реагент, содержащийся в израсходованном на титрование объеме стандартного раствора, прореагировали в количествах, равных количествам веществ их эквивалентов:
Математическое выражение закона эквивалентов:
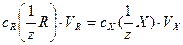 (4.1)
(4.1)
где 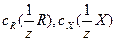 - молярные концентрации эквивалентов стандартного раствора реагента и определяемого вещества Х, [моль/дм3]; VR – объем стандартного раствора реагента, израсходованного на титрование (бюретка), [см3]; Vх – аликвотная часть исследуемого раствора, [см3].
- молярные концентрации эквивалентов стандартного раствора реагента и определяемого вещества Х, [моль/дм3]; VR – объем стандартного раствора реагента, израсходованного на титрование (бюретка), [см3]; Vх – аликвотная часть исследуемого раствора, [см3].
б) метод обратного титрования используется:
– когда вещество, содержание которого следует определить, реагирует с реагентом стандартного раствора, однако реакция при этом не сопровождается резким изменением концентрации в точке эквивалентности;
– когда реакция протекает медленно;
– когда не удается подобрать индикатор, резко меняющего свою окраску в точке конца титрования;
– когда определяемое вещество является летучим.
Суть метода обратного титрования сводится к следующему: к аликвотной части исследуемого раствора приливают заведомо известный избыток (точно измеренный объем) одного из стандартных растворов, затем непрореагировавшую его часть титруют стандартным раствором другого реагента.
Например, определение содержания карбоната кальция в известняке выполняют методом ацидиметрического титрования. При этом реакция углекислого кальция с соляной кислотой при постепенном ее прибавлении (в процессе прямого титрования) протекает медленно, поэтому прямое титрование в данном случае неприемлемо. Используют метод обратного титрования: к навеске карбоната кальция прибавляют заведомый избыток стандартного раствора соляной кислоты, нагревают до полного растворения навески карбоната кальция, а затем титруют оставшуюся, непрореагировавшую часть (избыток) соляной кислоты стандартным раствором щелочи. Зная общее количество взятой для анализа соляной кислоты, а также ее остаток, находят количество кислоты, затраченное на реакцию с карбонатом кальция.
Другой пример. Для определения содержания иона аммония в аммонийных солях исследуемый раствор обрабатывают заведомым избытком стандартного раствора щелочи и кипятят для удаления аммиака. Затем остаток щелочи титруют стандартным раствором соляной кислоты.
Расчеты при использовании метода обратного титрования выполняют по формуле:
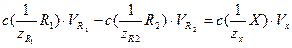 (4.2)
(4.2)
где 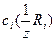 – молярная концентрация эквивалентов первого стандартного раствора реагента (раствор щелочи), [моль/дм3]; VR1 – объем первого стандартного раствор; , VR2 Vх– объем стандартного раствора соляной кислоты и раствора определяемого вещества соответственно, [см3].
– молярная концентрация эквивалентов первого стандартного раствора реагента (раствор щелочи), [моль/дм3]; VR1 – объем первого стандартного раствор; , VR2 Vх– объем стандартного раствора соляной кислоты и раствора определяемого вещества соответственно, [см3].
в)титрование заместителя. Этот метод используется тогда, когда невозможно применить методы прямого или обратного титрования. В этих случаях определяемый ион при помощи стехиометрической химической реакции переводят в такое химическое соединение, которое можно непосредственно титровать стандартным раствором реагента. В качестве примера можно привести йодометрическое определение меди.
Метод нейтрализации.
Методом нейтрализации путем прямого титрования можно определять содержание в анализируемых растворах сильных и слабых кислот, растворимых в воде оснований, кислых и гидролизующихся солей. В качестве реагентов (титрантов) используются стандартные растворы сильных кислот и оснований (щелочей). Стандартными называют водные растворы реагентов с точно известной молярной концентрацией эквивалента вещества в растворе. Точку конца титрования устанавливают в присутствии кислотно-основных индикаторов.
– титрование сильных оснований или сильных кислот.
В результате титрования в точке эквивалентности образуется соль сильного основания и сильной кислоты, которая не гидролизуется; рН раствора = 7. Наиболее подходящий кислотно-основный индикатор, показатель титрования (рТ) которого лежит в слабокислой или слабощелочной области, это растворы фенолфталеина или метилоранжа.– титрование слабых оснований.
В точке эквивалентности образуется гидролизующаяся соль – соль слабого основания и сильной кислоты. В результате гидролиза соли рН раствора в точке конца титрования будет меньше 7, следовательно, индикатор должен менять свою окраску в кислой среде. Такими свойствами обладают метиловый красный (метилрот), метиловый оранжевый (метилоранж).
– титрование слабых кислот.
При титровании раствора слабой кислоты раствором сильного основания в точке конца титрования образуется соль, вследствие гидролиза которой раствор имеет щелочную реакцию. Для фиксирования точки эквивалентности используют индикатор, способный изменять окраску в слабощелочной среде. Такими свойствами обладают фенолфталеин, тимолфталеин, метилоранж.
