Химического равновесия. Принцип Ле Шателье
Внешнее воздействие на систему приводит к смещению равновесия, т.е. изменению равновесных концентраций исходных веществ и продуктов реакции. Общий принцип смещения химического равновесия сформулировал Ле Шателье.
| Если на систему, находящуюся в равновесии, оказать внешнее воздействие, равновесие сместится в направлении, ослабляющем это воздействие. |
Влияние концентраций компонентов
Проиллюстрируем действие принципа Ле Шателье на примере реакции
CH4(г) + 2H2O(г)  CO2(г) + 4H2(г), DH>0.
CO2(г) + 4H2(г), DH>0.
Если в систему добавить метан CH4 или пары воды, т.е. увеличить их концентрацию, это приведет к смещению равновесия в сторону прямой реакции, в результате чего будут увеличиваться концентрации CO2 и H2. Если в систему ввести дополнительное количество диоксида углерода, то в соответствии с принципом Ле Шателье равновесие сместится в сторону обратной реакции, в результате концентрации метана и паров воды увеличатся, концентрация водорода уменьшится.
| Увеличение концентрации исходных веществ приводит к смещению равновесия в сторону прямой реакции, уменьшение – в сторону обратной реакции. Увеличение концентрации продуктов реакции приводит к смещению равновесия в сторону обратной реакции, уменьшение – в сторону прямой реакции. |
Влияние давления
Изменение общего давления оказывает влияние на равновесие только тех реакций, в результате которых меняется количество газообразных веществ.
| Увеличение давления приводит к смещению равновесия в сторону реакции, идущей с образованием меньшего количества газообразных веществ, т.е. в сторону уменьшения давления; понижение давления – к смещению равновесия в сторону реакции, идущей с образованием большего количества газообразных веществ. |
В рассматриваемой системе увеличение давления вызывает смещение равновесия в сторону обратной реакции, уменьшение давления – в сторону прямой реакции (слева 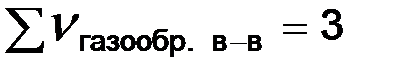 , справа
, справа 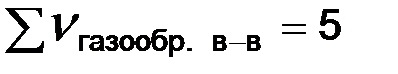 ).
).
Влияние температуры
Согласно принципу Ле Шателье, при нагревании равновесие должно смещаться в сторону реакций, идущих с поглощением теплоты, при охлаждении – в сторону реакций, идущих с выделением теплоты. В рассматриваемой системе нагревание приведет к смещению равновесия в сторону прямой реакции (эндотермической), охлаждение – в сторону обратной реакции (экзотермической).
| При повышении температуры равновесие смещается в сторону эндотермической реакции (∆H>0), при понижении температуры – в сторону экзотермической реакции (∆H<0). |
Влияние катализаторов
Присутствие катализаторов не смещает химическое равновесие. т. е. не позволяет увеличить глубину прохождения реакции и получить больше продукта. Катализаторы увеличивают скорость достижения равновесия.
