Химическое равновесие. Константа равновесия. Сдвиг химического равновесия – принцип Ле-Шателье
Большинство реакций обратимо, и рано или поздно в обратимом процессе устанавливается химическое равновесие. Изменение температуры равновесной системы, концентраций ее составных частей, а в некоторых случаях и внешнего давления, приводит к нарушению равновесия. Такое состояние продолжается, как правило, недолго. Через некоторое время вновь устанавливается состояние равновесия. Однако новое состояние характеризуется другими величинами равновесных концентраций.
Химическое равновесие – динамическое, то есть процесс будет продолжаться с равными скоростями и в прямом и в обратном направлениях. О степени протекания (направлении и глубине) процесса в момент равновесия можно судить по константе равновесия Кравн.
Константа равновесия – отношение произведения равновесных концентраций продуктов реакции в степенях, равных их стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных их стехиометрическим коэффициентам, при постоянных давлении и температуре.
а1А1 + а2А2 + …= в1В1 + в2В2 + …
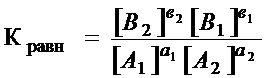 .
.
Концентрации твердых фаз в уравнение константы равновесия не входят (так как она постоянна и равна единице).
Для реакций в газовой фазе используют парциальное давление – частное давление, создаваемое отдельным газом pi. Согласно закону Дальтона, общее давление системы pсист равно сумме парциальных давлений газов, входящих в эту смесь 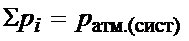 .
.
Значение Кравн определяет направление и глубину процесса. Если Кравн >1, то благоприятно протекание прямой реакции. Чем больше Кравн, тем полнее происходит взаимодействие. Если Кравн<1, то преимущественно протекает обратная реакция.
Очевидно, чем значительнее убыль ∆G, тем больше Кравн:
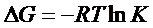 .
.
Это соотношение универсально и применимо к любым процессам равновесия.
Константа равновесия не зависит от концентрации исходных веществ и продуктов реакции, от давления. Зависит от природы реагентов и от температуры.
Химическое равновесие при данных условиях сохраняется бесконечно долго. Изменение условий нарушает равновесие системы.
Принцип Ле-Шателье:
Если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в том направлении, которое ослабляет это воздействие.
Рассмотрим влияние внешних факторов.
Влияние концентрации
А) При повышении концентрации исходных веществ равновесие сдвигается в сторону прямой реакции, т.е. вправо. Повышение концентрации продуктов реакции смещает равновесие в сторону обратной реакции, т.е. влево.
Рассмотрим, в какую сторону смещается равновесие при увеличении концентрации или парциальных давлений исходных веществ в 2 раза.
Для этого в выражении закона действующих масс (кинетическое уравнение) для прямой реакции (п. 5.1) концентрацию или парциальное давление каждого вещества необходимо увеличить в 2 раза, тогда получаем, что
для реакции а Vпр =kпр.[2∙NH3]4·[2∙O2]3, Vпр. = kпр.·2Р  ∙2Р
∙2Р 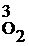 ; т.е. Vпр возрастает в 24·23 = 27 раз;
; т.е. Vпр возрастает в 24·23 = 27 раз;
для реакции б Vпр. = kпр.[2∙SO2]2, или Vпр. = kпр. 2∙Р  ;
;
Vпр возрастает в 22 раз.
Скорость обратной реакции не зависит от концентрации исходных веществ и остается постоянной. Поэтому в обоих случаях равновесие смещается в сторону продуктов реакции.
Влияние давления
Изменение давления влияет на реакции, протекающие с изменением числа молей.
Б) Повышение давления смещает равновесие в направлении уменьшения объема (∆V<0), и наоборот, понижение давления сдвигает равновесие в сторону увеличения объема (∆V>0).
Если увеличить объем всей системы в 3 раза, то концентрация (или парциальное давление) каждого вещества уменьшится в 3 раза. В результате уменьшится скорость как прямой, так и обратной реакции.
Для варианта а Vпр уменьшится в 34·33 = 37, а
Vобр уменьшится в 32·36 = 38 раз.
Таким образом, больше окажется скорость прямой реакции, и равновесие сдвигается вправо.
Для варианта б Vпр уменьшится в 32 = 9 раз, а
Vобр снизится в 33 = 27 раз.
Таким образом, равновесие реакции смещается вправо.
Влияние температуры
В) Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение температуры – в сторону экзотермической.
В случае а ΔН0х.р. < 0, энтальпия системы уменьшается. Следовательно, прямая реакция сопровождается выделением тепла и является экзотермической. Тогда обратная реакция будет эндотермической, т.е. сопровождается поглощением тепла. При нагревании ускоряется реакция, идущая с поглощением тепла, т.е. обратная. Равновесие смещается влево.
В случае б ΔН0х.р. > 0. Прямая реакция протекает с поглощением тепла и является эндотермической, а обратная – экзотермической. Нагревание способствует ускорению прямой реакции, и равновесие сдвигается вправо.
КОНТРОЛЬНЫЕ ВОПРОСЫ
5.1. Что является предметом изучения химической кинетики?
5.2. Приведите по два примера гомогенных и гетерогенных процессов.
5.3. Что называется скоростью химической реакции и от каких факторов она зависит?
5.4. Приведите по два примера обратимых и практически необратимых процесса.
5.5. Сформулируйте закон действующих масс. Напишите математическое выражение закона действующих масс для газофазной реакции: 2SO2 + O2 = 2SO3.
5.6. Напишите математическое выражение скорости гомогенных реакций:
а) 2A + 3B = A2 B3;
б) N2O4 = NO2.
5.7. Чему равна константа скорости химической реакции в уравнении V = k[A][B]? Каков физический смысл этой величины?
5.8. Напишите выражение для скорости прямой и обратной реакции каждого из следующих газофазных процессов:
а) N2 + O2 = 2NO;
б) CO + Cl2 = COCl2;
в) N2 + 3H2 = 2NH3.
5.9. Вычислите, во сколько раз увеличатся или уменьшатся скорости этих реакций, если при неизменной температуре: а) уменьшить концентрацию каждого вещества в два раза; б) увеличить давление в три раза.
5.10. Объясните сущность правила Вант-Гоффа. Какие значения принимает температурный коэффициент для большинства химических реакций?
5.11. Какие факторы влияют на увеличение скорости реакции? Отметьте влияние величины поверхности соприкосновения реагирующих веществ на скорость взаимодействия.
5.12. Приведите выражение константы равновесия гомогенной реакции в общей форме, объясните её физический смысл.
5.13. В чем заключаются различия понятий «константа скорости» и «константа равновесия»?
5.14. Напишите выражение для константы равновесия для каждого из следующих обратимых процессов:
а) 2NO2 = N2O4;
б) 2NO2 = 2NO + O2;
в) 3H2 + N2 = 2NH3;
г) FeO + H2 = Fe + H2O(пар);
д) C + H2O (пар) = H2 + CO.
Куда сместится равновесие в каждом из указанных случаев при увеличении давления?
5.15. В каком направлении сместится равновесие при повышении температуры в следующих обратимых реакциях:
а) 2SO2 + O2 = 2SO3 + 196,6 кДж;
б) H2 + Br2 = 2HBr + 73,2 кДж;
в) N2 + O2 = 2HBr + 2NO – 180,7 кДж;
г) 2N2 + O2 = 2N2O – 163,2 кДж?
РАСТВОРЫ И ИХ СВОЙСТВА
