Самостійна робота студентів
1. Назвати речовини за міжнародною номенклатурою
СІ С2Н 5 С С С
С – С – С – С ≡ С С – С – С = С – С = С – С С = С – С – С – С
С С С С С
2. Написати напівструктурні формулу речовини за відомою номенклатурною назвою.
А) 2,3-диметил – 4 хлорпент-1-ен
Б) 3,3,4,5-тетрабромгекс-1-ин
В) 2,4 –диметил -5-етилгепта-1,3-дієн
Г) 2,5-диметил-3,3-диетилгаксан.
3. Написати напівструктурні формули ізомерів
А) октену
Б) гексадієну
4. Задачі на використання загальної формули органічних речовин.
А) серед переліку речовин виберіть формули алкінів: С7Н14, С5Н10, С2Н4, С6Н6, С2Н2.
Б) напишіть формулу алкану у якого є 16 атомів Гідрогену
В) напишіть формулу алкіну у якого є 6 атомів Карбону
Г) напишіть формулу алкену у якого є 16 атомів Гідрогену
5. Написати рівняння реакцій , що лежать в основі поданої схеми
СН4→С2Н2→С2Н4→С2Н5СІ→С4Н10→С4Н8→С4Н9ОН
6. Задачі на виведення формул за відомою масовою часткою елементів сполуки. Алгоритм рішення.
Визначте молекулярну формулу речовини, що містить натрію 42,07% , фосфору- !8,9% , оксисену – 39,05%. Густина пари речовини за азотом 5,857.
1. Напишіть умову задачі.
Дано
ω(Na)=42,07%
ω(P)=18,9%
ω(O)=39,05%
D(N2)=5,857
NaxPyOz
2.за відносною густиною пари речовини відносно азоту знайдемо молярну масу нашої сполуки
Дано
ω(Na)=42,07% Mr= D(N2) ×Mr(N2)=5,857×28=163,99=164 г/моль
ω(P)=18,9%
ω(O)=39,05%
D(N2)=5,875
NaxPyOz
3.Для того ,щоб визначити масову частку елементів у сполуці використали формулу
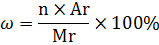
З даної формули знайдемо чому дорівнює індекс n:
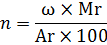
Використаємо дану формулу в нашій задачі і знайдемо індекс для кожного елемента
Дано
ω(Na)=42,07% Mr= D(N2) ×Mr(N2)=5,857×28=163,99=164 г/моль
ω(P)=18,9% 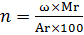
ω(O)=39,05%
D(N2)=5,875
NaxPyOz 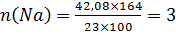
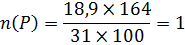
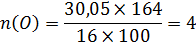
Відповідь: Na3PO4
Розв’яжіть задачі:
1. Масові частки елементів у органічній сполуці рівні Карбону 76, %, Гідрогену 12,7%, Оксисену 11,3. Густина парів сполуки за киснем 8,875 . Знайдіть формулу сполуки.
2. Масові частки Карбону, Гідрогену та Хлору відповідно рівні 56,3%, 10,4 %, 33.3%. Густина за воднем 53,25. Знайдіть формулу сполуки.
Тема 4 Вуглеводні
Заняття 4.Арени.
Вид заняття:Групове заняття 11
Мета:ознайомитись з бензеном – представником гомологічного ряду аренів, з особливостями нового виду зв’язків – бензольного ядра; установити причинно-наслідкові зв’язки властивостей бензену та його будови; визначити хімічні властивості бензену : реакції приєднання, заміщення, окиснення; удосконалювати вміння студентів складати рівняння реакцій між речовинами.
Навчальні питання:
1.Бензен, склад, електронна та структурна формула,, фізичні властивості. Номенклатурні назви аренів.
2. Хімічні властивості бензену.
3.Застосування бензену. Хімічні засоби захисту рослин.
Навчальна література :
Л-3 с.74-83
Л-4 с.78-81
ІІІ.Арени.
| Визначення | Функціональні групи | Загальна формула | Номенк- латурна назва | Види ізомерії | Будова | Застосування | Добування | Фізичні і Хімічні властивості |
| Арени- це карбоциклічні сполуки , до складу яких входять одне ,або кілька бензольних ядер. | Бензольне ядро бензен | CnH2n-6, де n ≥ 6 | Номера цін починається від першого замісника в сторону наступного,закінчена бензен | 1.Ізомерія положення замісника 2.Ізомерія виду замісника. | Кожен атом карбону у циклі знаходиться в стані sр2 шість карбонів утворюють замкнене коло, що містить шість δ- зв’язків, 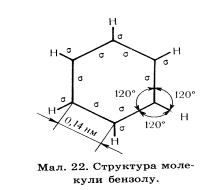 Шість не гібридизованих р- орбіталей розміщуються перпендикулярно площині δ- зв’язків, та утворюють спільний для всіх шести атомів π-зв'язок – бензольне ядро Шість не гібридизованих р- орбіталей розміщуються перпендикулярно площині δ- зв’язків, та утворюють спільний для всіх шести атомів π-зв'язок – бензольне ядро | 1.сировина для синтезу: барвників, лікарських препаратів, полімерів, отрутохімікатів, вибухових речовин, 2.розчинник 3.похідні бензину – пестициди | 1.з продуктів коксування кам’яного вугілля. 2.з нафти ,з циклоалканів Т=500 0С, Р=2500 – 5066 кПа, каталізатор. залізо С6Н12→С6Н6 +3Н2 3.дегідроциклізація алканів С7Н16 →С7Н8 +4Н2 4.тримеризація ацетилену ,Т=800 0С , каталізатор – розжарене вугілля 3С2Н2→С6Н6 | Рідина з специфічним запахом, Т кип=80 0С , нерозчинний у воді, розчинний у неполярних розчинниках: керосині, бензині, ацетоні. Бензен- отруйна речовина. Вдихання парів бензину викликає запаморочення , головний біль, при високих концентраціях – можлива втрата свідомості. 1.горить 2С6Н6 + 5О2→12СО2+6Н2О 2. заміщення. Каталізатори FeCl3, AlCl3. C6H6+ Cl2→C6H5Cl +HCl 3.нітрування. каталізатор - H2SO4 C6H6+HNO3→C6H5NO2 +H2O 4.сульфування C6H6+ H2SO4 →C6H5SO3H +H2O 5.Приєднання. А) гідрування: Т=200 С ,Р=5066 кПа, світло, каталізатори нікель, платина. C6H6+3H2→C6H12(циклогексан) Б) галогенування: каталізатор - ультрафіолетове світло C6H6+3Cl2→C6H6Cl6(гексахлорциклагексан) 6.Не діють на розчин марганцівки та бромної води. |
Будова молекули бензену.
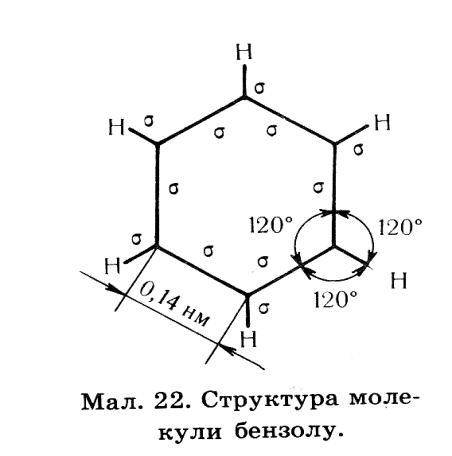
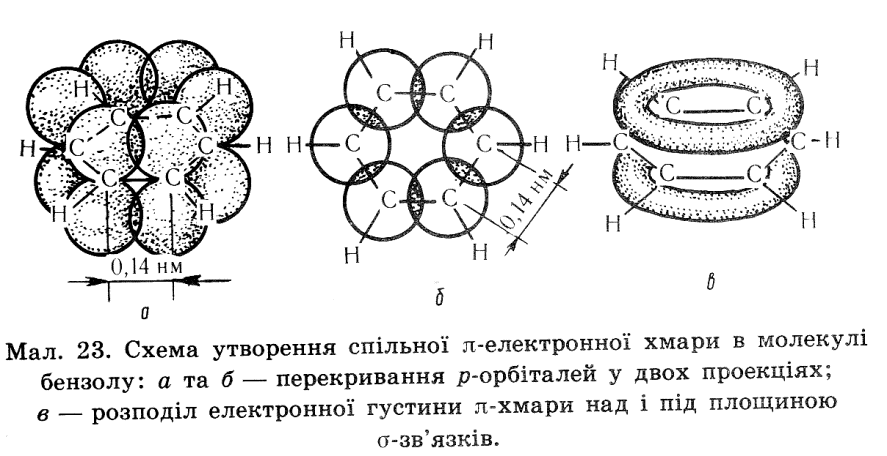
Кожен атом карбону у циклі знаходиться в стані sр2 гібридизації отже три гібридизовані орбіталі кожного з шести карбонів утворюють рівносторонній трикутник на площині. Дві орбіталі кожного трикутника з’єднані з сусідніми такими ж орбіта лями,утворюючи замкнене коло, що містить шість δ- зв’язків, третя орбіталь кожного карбону зв’язана з атомом гідрогену.
Не гібридизовані р- орбіталі кожного атома карбону розміщується перпендикулярно площині δ- зв’язків, ці орбіталі по черзі перекриваються , утворюючи спільний для всіх шести атомів π-зв'язок – бензольне ядро.
Пестициди - - речовини що використовуються в сільському господарстві для захисту рослин. Гербіциди – боротьба з бур’янами. Інсектициди – боротьба з комахами. Фунгіциди – боротьба з грибками. Зооциди – боротьба з тваринами-шкідниками.
Приклади назв аренів по міжнародній номенклатурі.
СН3
СН3
1,2-диметилбензен.
