Взаимодействие кислот с металлами есть окислительно-восстановительный процесс. Окислителем является ион водорода, который принимает ионы от металла
Взаимодействие металлов с растворами солей менее активных металлов можно иллюстрировать примером действия железа на раствор сульфата меди. В этом случае происходит отрыв электронов от атомов более активного металла (железа) и присоединение их ионами менее активного (меди).
Активные металлы взаимодействуют с водой,которая выступает в роли окислителя.
При взаимодействии металлов с концентрированной серной кислотой следует иметь в виду, что окислителем является сульфат-анион SO42–. А не ион Н+, Так, в случае неактивного металла (Ео>–0,5 В) сера восстанавливается до +4 (SO2), а в случае активного металла (Ео < –0,5 В) сера восстанавливается до 0 (S) или –2 (H2S).
. Реакция концентрированной серной кислоты с цинком. Так как для цинка Ео=–0,763 В, значит, сульфат–анион SO42– способен восстанавливаться до H2S.
Реакция будет протекать по схеме:
Fe + H2SO42– → FeSO4 + H2S + H2O,:
Fe–2e→Fe2+ процесс окисления, восстановитель
S+6 +8e→ S-2 процесс восстановления, окислитель
Взаимодействие металлов с разбавленной и концентрированной азотной кислотой. В азотной кислоте окислителем является нитрат – анион NO3–. Характерная особенность азотной кислоты состоит в том, что при её действии на металлы обычно не происходит выделения газообразного водорода. При восстановлении нитрат –аниона степень окисления азота уменьшается с +5 до +4, +3, +2, +1, 0, или даже –3. При этом образуются различные оксиды азота или нитрат аммония. Степень окисления азота также зависит от концентрации кислоты и активности металла.
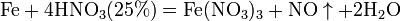
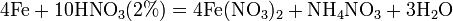
Вопрос28. Возникновение скачка потенциала на границе металл-раствор соли металла. Стандартный электродный потенциал. Ряд стандартных электронных потенциалов металлов. Какие выводы можно сделать исходя из положения металла в ряду
В силу того, что у атомов поверхности металлов валентные возможности реализованы не полностью, и на границе металл- электролит возникает промежуточная фаза, состоящая из гидратированных атомов металла. [Me*nH2O]= [Me*nH2O]+ne. Рано или поздно между анодным и катодным процессом установится равновесие. В силу стремления металла к окислению к моменту равновесия некоторое кол-во ионов металла остается в растворе электролита, а избыточное количество электронов - в металле. На границе раздела возникает скачок потенциала. Скачок потенциала, который возникает на границе раздела фаз, при переходе металла из вакуума в раствор электролита, наз. электродным потенциалом металла. Это – термодинамическая характеристика системы металл-электролит. Чем более активный металл, тем он больше стремиться к окислению, тем больше будет величина скачка потенциала на границе раздела фаз, тем более будет отрицательный электродный потенциал. Величину электродного потенциала измеряют путем сравнения: определяют разность потенциалов между рассматриваемой системой металл-электролит (рабочий электрод) и другой подобной рабочей системой, потенциал которой принят за ноль. Когда каждая реакция(окисл\восст) протекает в гальваническом элементе или при электролизе то каждая реакция происходит на соотв. электроде, то такие полу-реакции называются электродными процессами. Ряд стандартных электродных потенциалов располагает Ме в порядке возрастания величин СЭП. Выводы:1) Чем левее расположен Ме в ряду и чем меньше величина его электроотриц потенциала, тем он химически активнее, тем легче Ме окислить, тем труднее воостанавливаются его ионы.2)Чем правее расположен Ме в ряду и чем больше величина его электроотриц потенциала, тем он химически менее активен, тем легче восстанавливаются его ионы.3)Все Ме, стоящие до Н способны вытеснять водород из разбавл кислот, стоящие правее – не вытесняют.4)Чем дальше друг от друга расположены Ме в ряду, тем большую ЭДС будет иметь состоящий из них гальванический элемент.5) Ме , стоящий в ряду до Mg, вытесняет H из H2O 6)Каждый Ме этого ряда вытесняет стоящий за ним Ме из растворов их солей
