Закон разбавления Оствальда для слабых электролитов
В растворе слабого электролита устанавливается равновесие между ионами и непродиссоциировавшими молекулами, которое подчиняется закону действующих масс и количественно характеризуется константой равновесия:
НСlO ⇄ H+ + ClO–
Кдис. = 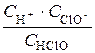 ,
,
где СН 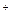 , СClO
, СClO 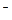 , CHClO – равновесные концентрации ионов и молекул.
, CHClO – равновесные концентрации ионов и молекул.
Концентрации СН 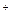 , СClO
, СClO 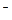 , CHClO могут быть выражены через начальную концентрацию электролита Сo(НСlO) и степень диссоциации
, CHClO могут быть выражены через начальную концентрацию электролита Сo(НСlO) и степень диссоциации
a = 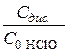 ;
;
Сдис. = С0 НСlO × a,
где Сдис. – концентрация продиссоциировавших молекул.
Равновесная концентрация кислоты:
СНСlO = C0 HClO – a × C0 HClO.
Равновесная концентрация образующихся ионов:
Сдис. = СН 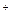 = СНClO.
= СНClO.
Тогда
Кдис. = 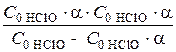
Кдис. = 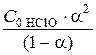 (математическое выражение закона разбавления Оствальда)
(математическое выражение закона разбавления Оствальда)
Для слабых электролитов, имеющих незначительные величины степени диссоциации, величиной a в знаменателе можно пренебречь и считать, что 1–a = 1.
Тогда: Кдис. = САВ × a2
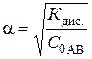 ,
,
что степень диссоциации слабого электролита увеличивается при разбавлении, то есть уменьшении начальной концентрации.
Ионно-молекулярные уравнения реакций показывают сущность реакций, протекающих в растворах электролитов. При этом малорастворимые вещества, слабые электролиты и неэлектролиты записываются в виде молекул, поскольку концентрация ионов, образующихся за счет их диссоциации, в растворе очень мала, основная форма существования соединений - молекулы. В ионном виде записываются только сильные электролиты: растворимые соли, ряд кислот, щелочи.
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
сильный сильный малораст. слабый
растворим растворим
Ba+2 + 2OH– + 2H+ + SO 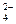 = BaSO4 + 2H2O
= BaSO4 + 2H2O
в сокращенном виде:
Ba2++ SO 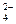 = BaSO4
= BaSO4
Cu(OH)2 + 2HCl = СuCl2 + 2H2O
слабый сильный растворим слабый
малораств.
Cu(OH)2 + 2H+ + 2Cl– = Cu+2 + 2Cl– + 2H2O
в сокращенном виде:
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
ZnS + 2HCl = ZnCl2 + H2S
нерастворим растворим растворим слабый
ZnS + 2H+ +2Cl- = Zn2+ +2Cl- +H2S
уравнение в сокращенном виде:
ZnS + 2H+ = Zn2+ + H2S
В растворах сильных электролитов концентрация ионов велика, между ними заметно проявляются силы межионного взаимодействия, поэтому ионы оказываются несвободными в своем движении и свойства электролита, зависящие от числа ионов, проявляются слабее, чем следовало ожидать при полной диссоциации электролита на невзаимодействующие между собой ионы. Для объяснения многообразия факторов, влияющих на свойства сильных электролитов, пользуются понятием активности иона. Активность иона – это (доля ионов) концентрация вещества, которая проявляет себя в действии.
Активность иона 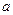 (моль/л) определяется выражением
(моль/л) определяется выражением
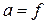 С,
С,
где 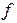 – коэффициент активности, С – начальная концентрация электролита;
– коэффициент активности, С – начальная концентрация электролита; 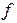 – отражает взаимодействие силовых полей ионов, имеющих место в данной системе.
– отражает взаимодействие силовых полей ионов, имеющих место в данной системе.
В сильноразбавленных растворах 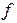 = 1, поэтому в расчетах, связанных с незначительными концентрациями, активность можно считать равной концентрации.
= 1, поэтому в расчетах, связанных с незначительными концентрациями, активность можно считать равной концентрации.
Коэффициент активности зависит:
1. от концентрации раствора;
2. от природы и заряда иона;
Ионное произведение воды
Процесс электролитической диссоциации воды в соответствии со схемой
Н2О ⇄ Н+ + ОН–
количественно характеризуется константой равновесия
Кдис. = 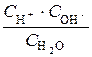 = 1,8 × 10–16 (при 220С).
= 1,8 × 10–16 (при 220С).
Процесс протекает очень неглубоко, можно считать, что равновесная концентрация недиссоциированных молекул воды равна общей (начальной) концентрации молекул воды; то есть СН  О =
О = 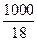 = 55,5 моль/л.
= 55,5 моль/л.
Тогда Кдис. × СН 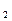 О = CH
О = CH 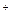 × COH
× COH 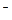 = Кw;
= Кw;
Кw – постоянная величина (при определенной температуре), которую называют ионным произведением воды.
В чистой воде ионы Н+ и ОН– появляются только за счет электролитической диссоциации воды, их концентрации одинаковы: СН 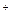 = СОН
= СОН 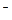 =
= 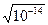 = 10–7 моль/л.
= 10–7 моль/л.
Раствор, в котором СН 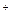 = СОН
= СОН 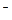 , принято называть нейтральным.
, принято называть нейтральным.
При добавлении в воду кислоты или основания равновесие диссоциации воды в соответствии с принципом Ле Шателье смещается влево, нарушается соотношение СН 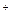 = СОН
= СОН 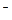 , но Kw остается неизменной.
, но Kw остается неизменной.
Водородный показатель рН
Для водных растворов важное значение имеет оценка кислотности раствора. Для этого используют водородный показатель – отрицательный десятичный логарифм молярной концентрации ионов водорода в растворе
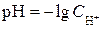
или гидроксильный показатель
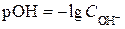 .
.
Для воды и разбавленных водных растворов справедливо соотношение
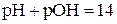 .
.
СН 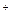 = СОН
= СОН 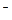 = 10–7 моль/л – нейтральная среда;
= 10–7 моль/л – нейтральная среда;
СН 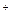 > СОН
> СОН 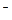 , СН
, СН 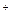 > 10–7 моль/л – кислая среда;
> 10–7 моль/л – кислая среда;
СН 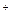 < СОН
< СОН 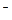 , СН
, СН 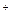 < 10–7 моль/л – щелочная среда.
< 10–7 моль/л – щелочная среда.
Для чистой воды pH = 7. Растворы, для которых pH близок к 7, называют нейтральными. Если pH < 7, то раствор будет кислым, а если pH > 7 – щелочным.
Примеры решения задач
Пример 1. Вычислите концентрацию ионов H+, OH– и pH в растворе: а) 0,1 М HNO2; б) 0,1 н. H2SO4; в) NaOH плотностью 1 г/мл с массовой долей NaOH, равной 0,04 %.
| а) Дано: C0 = 0,1 моль/л | Решение. Записываем уравнение диссоциации кислоты HNO2«H++NO2- |
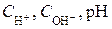 – ? – ? |
Поскольку кислота слабая степень диссоциации находим по формуле
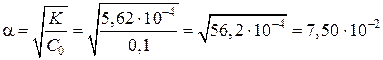 .
.
При диссоциации кислоты образуются ионы H+. Их концентрацию определяем по формуле
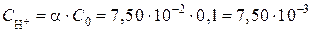 моль/л.
моль/л.
Концентрацию ионов OH– рассчитываем из выражения для ионного произведения воды:
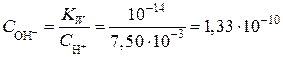 моль/л.
моль/л.
Находим pH:
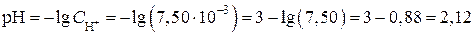 .
.
б) Дано: 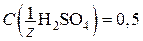 моль/л моль/л | Решение. H2SO4 – сильная кислота: 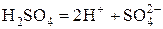 . Для сильных электролитов . Для сильных электролитов 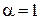 . Концентрация ионов H+ будет равна . Концентрация ионов H+ будет равна |
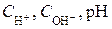 – ? – ? |
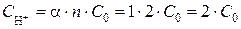 (в реакции образуется 2 иона H+).
(в реакции образуется 2 иона H+).
Определяем C0 (молярную концентрацию H2SO4):
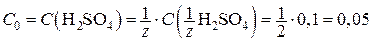 моль/л.
моль/л.
Тогда
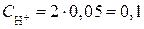 моль/л;
моль/л;
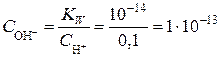 моль/л;
моль/л;
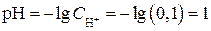 .
.
| в) Дано: w(NaOH) = 0,04% или 0,0004 rр-ра = 1 г/мл | Решение. NaOH – сильный электролит: 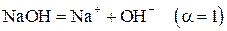 образует ионы OH–. Тогда образует ионы OH–. Тогда |
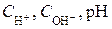 – ? – ? |
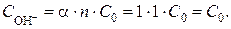
Находим C0 (молярную концентрацию NaOH):
пусть Vр-ра = 1 л = 1000 мл;
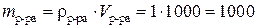 г;
г;
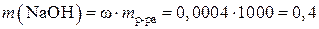 г;
г;
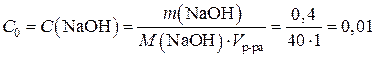 моль/л.
моль/л.
Тогда
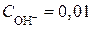 моль/л;
моль/л;
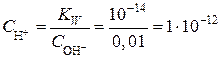 моль/л;
моль/л;
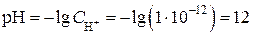 .
.
Пример 2. Определите степень диссоциации угольной кислоты в 0,01 М растворе, учитывая только первую ступень диссоциации, если pH этого раствора равен 4,17.
| Дано: C(H2CO3) = 0,01 моль/л pH = 4,17 | Решение. Уравнение диссоциации кислоты по первой ступени имеет вид: H2CO3«H++HCO3- (I ступень) Вычисляем концентрацию ионов H+: |
| a – ? |
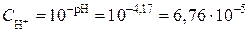 моль/л.
моль/л.
Степень диссоциации находим так
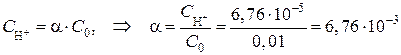 моль/л.
моль/л.
