Константа диссоциации. Факторы ее определяющие. Закон разбавления Оствальда.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции
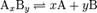
где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
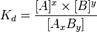
где [A], [B] и [AxBy] — концентрации A, B и комплекса AxBy соответственно.
Константа диссоциации зависит только от температуры, но не зависит от концентрации раствора.
Сильные электролиты диссоциируют практически нацело (реакция необратимая), поэтому термин «константа диссоциации» для них лишён значения.
Примеры расчётов:
Диссоциация воды
Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением
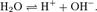
Константа диссоциации воды при 25°С составляет
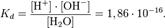
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn: 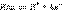
Константа равновесия Kр этой реакции и есть Kд: 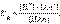
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации б, то получим 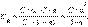
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при б << 1 это уравнение упрощается: 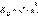
Тогда 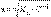
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации б стремится к единице.
Фазовая диаграмма воды. Ионное произведение воды. Водородный и гидроксильный показатели. Способы измерения и расчета рН и рОН.
Фа́зовая диагра́мма воды — диаграммы, выражающие зависимость сост-я с-мы и фазовых равновесий в ней, от внешних условий и от её состава.
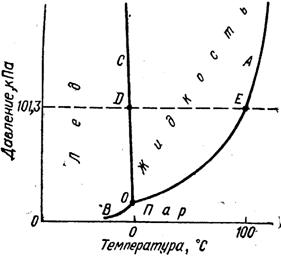
3 кривые разделяют диаграмму на области, каждая из которых отвечает 1му агрег. сост. Каждая область имеет 1 фазу(однофазно) =>кол-во степеней своб. =2
Ионное произведение воды
Вода также диссоциирует, хотя и в небольшой степени:
H2O " H+ + ОН-
Константа диссоциации для этого процесса равна:
К = ([H+]*[OH-])/[H2O]
Концентрация недиссоциированных молекул воды равна общему числу моль в 1 л воды, т. е. [H2O] = 1000/18 = 55,56 моль и [H+]*[ОН-] = 10-14. Произведение концентрации ионов H+ и ОН- при определенной температуре постоянно. При температуре 25°С его называют ионным произведением воды
Концентрации ионов H+ и OH- равны, следовательно [H+] = [OH-] = 10-7 моль/л. Раствор с одинаковыми концентрациями ионов называется нейтральным. Если [H+] > [OH-] то раствор кислый, наоборот - [H+] < [ОН-] - щелочной или основный.
Водоро́дный показа́тель, pH —мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
рОН = - lg[OH-]
Для нейтральной среды рН = 7, для кислой рН < 7 и для щелочной рН > 7
Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
