Константа диссоциации. Закон разбавления Оствальда.
Электролиты, диссоциирующие не полностью, называются слабыми электролитами. В их растворах устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. Например в водном растворе уксусной кислоты устанавливается равновесие
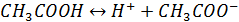 ,
,
Константа диссоциации связана с концентрациями следующих частиц соотношением:
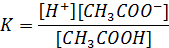
Чем больше значение Kд, тем сильнее данный электролит.
В случае электролита AX, диссоциирующего на ионы A+ и X-, константа и степень диссоциации связаны соотношением
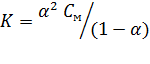
Здесь СМ – молярная концентрация электролита, моль/л.
Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1-α≈1. Тогда выражение закона разбавления Освальда упрощается:
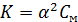 , откуда
, откуда 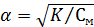
степень диссоциации возрастает при разбавлении, и выражает закон разбавления Оствальда.
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно к нему можно применить закон действующих масс и записать константу равновесия слабого электролита, она называется константа диссоциации:
АВ = А+ + В‾
Кд = [ A+] * [B-] / [AB]
КД зависит от природы электролита и растворителя, от температуры и не зависит от концентрации раствора. Чем выше КД, тем легче электролит диссоциирует. При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Соблюдается неравенство: КД1 > КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени.
13. Комплексные соединения. Их структура.
Комплексные соединения – это определённые химические соединения, образованные сочетанием отдельных компонентов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так ив растворённом состоянии.
В молекуле комплексного соединения один из атомов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем, или центральным атомом. В непосредственной близости к нему расположены (координированы) противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения. Общее число σ-связей, образуемых комплексообразователем с лигандами, называется координационным числом центрального иона. По числу σ-связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, ди- и более дентатные лиганды.
За пределами внутренней сферы комплексного соединения находится его внешняя сфера, содержащая положительно заряженные ионы (если внутренняя сфера комплексного соединения заряжена отрицательно) или отрицательно заряженные ионы (если наоборот); в случае незаряженной внутренней сферы внешняя сфера отсутствует.
Ионы, находящиеся во внешней сфере, связаны с комплексным ионом силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов. Лиганды, находящиеся во внутренней сфере комплекса, связаны с комплексообразователем ковалентными связями, и их диссоциация в растворе осуществляется в незначительной степени. С помощью качественных реакций обнаруживаются только ионы внешней сферы.
