Строение и свойства атомов
1.Квантово-механическая модель строения атома, уравнение де Бройля, принцип Гейзенберга, волновая функция, уравнение Шредингера.К сожалению, описать атомы со сложной структурой, опираясь на модель Бора, не представляется возможным. Поэтому, в 20-х годах прошлого века получила широкое распространение квантово-механическая модель (КММ) атома. В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями ("электронные облака" - области пространства в которых существует вероятность пребывания электрона). Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми: Главное квантовое число n (описывает Энергетический уровень орбитали, принимает значения n=1,2,3,…). Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки. Орбитальное квантовое числоL(Описывает форму орбитали, принимает значения от 0 до n-1). Орбитали, имеющие одинаковое n, но разные L называют энергетическими подуровнями и обозначают буквами латинского алфавита: s,p,d,f,g. Магнитное квантовое число m(Описывает ориентацию орбиталей в пространстве, принимает значения -L,0,L).Например: Для L=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию. Для L=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации. Cпиновое квантовое число ms (Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½). Для частиц не очень высокой энергии, движущихся со скоростью v<<c (скорости свет), 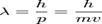 , где h=6,626*10-34Дж*с – постоянная Планка. Волновая функция, или пси-функция
, где h=6,626*10-34Дж*с – постоянная Планка. Волновая функция, или пси-функция 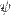 — функция, используемая в квантовой механике для описания движения электрона в атоме.
— функция, используемая в квантовой механике для описания движения электрона в атоме. 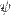 2 – характеризует вероятность нахождения электрона в данной точке атомного пространства и определяется с помощью уравнения Шрёдингера
2 – характеризует вероятность нахождения электрона в данной точке атомного пространства и определяется с помощью уравнения Шрёдингера 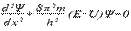 , де x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы. В 1927г. Гейзенберг постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств.
, де x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы. В 1927г. Гейзенберг постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств.
2. Квантовые числа: главное, орбитальное, магнитное, спиновое. Понятие атомная орбиталь (АО).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми: Главное квантовое число n (описывает Энергетический уровень орбитали, принимает значения n=1,2,3,…). Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки. Орбитальное квантовое числоL(Описывает форму орбитали, принимает значения от 0 до n-1). Орбитали, имеющие одинаковое n, но разные L называют энергетическими подуровнями и обозначают буквами латинского алфавита: s,p,d,f,g. Магнитное квантовое число m(Описывает ориентацию орбиталей в пространстве, принимает значения -L,0,L).Например: Для L=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию. Для L=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации. Cпиновое квантовое число ms (Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½). Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома, задается главным n, орбитальным l и магнитным m квантовыми числами. Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
3.Строение многоэлектронных атомов: принципы и правила размещения электронов в атоме. Исключения из правила Клечковского. В многоэлектронных атомах, как и в атоме водорода, состояние каждого электрона можно характеризовать квантовыми числами. Межэлектронное отталкивание приводит к тому, что энергия электронов, имеющих одно и то же значение n, но разные значения l, становится различной. Последовательность заполнения е подуровней определяется принципом наименьшей энергии, принципом Паули и правилом Хунда. Принцип наименьшей энергии: заполнение электронами АО происходит в порядке возрастания их энергии. Установлена энергетическая диаграмма для различных АО в много-е нейтральных атомов, находящихся в основном состоянии(с наименьшей энергией). Правило Клечковского: энергия АО возрастает в соотв. с увеличением n+l. При одинаковом значении суммы энергия меньше у АО с меньшим значением n. Принцип Паули: в атоме не м.б. 2 е с одинаковым значением 4х квантовых чисел. Этот набор значений полностью определяет энергетическое состояние е. 2 е, находящихся на одной АО называются спаренными. Общее число орбиталей на эн. уроне со зн. n = n*2. Следовательно, max электронная емкость = 2n*2. Правило Хунда определяет последовательность заполнения АО е в пределах одного подуровня и гласит: При данном значении l (в пределах 1 подуровня) в основном состоянии электроны располагаются т.о., что значение суммарного спина атома max(на подуровне должно быть max число неспаренных e). Распределение е по различным АО называют е конфигурацией атома.Эл. конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. ЭК атома изображают 2мя способами: в виде е формул и е-графических диаграмм. При написании е формул используют n и l. Подуровень обозначают с помощью n и l(буквой). Число е на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода: 1s1. В случае е-графических диаграмм распределение е по подуровням представляют в виде квантовых ячеек. Орбиталь принято изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне д.б. немного смещены по высоте (энергия различна). Электроны изображаются против. стрелками в завис. от значения спина.С учетом структуры ЭК атомов все известные Эл. в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на 4 группы: s, p, d и f-элементы. Отклонения от правила n+l наблюдаются у некоторых элементов – это связано с тем, что с увеличением главного квантового числа различия между энергиями подуровней уменьшаются.
4.Окислительно-восстановительные свойства атомов и ионов: энергия ионизации, энергия сродства к электрону, электроотрицательность, орбитальный радиус. Энергия ионизации – это энергия, необходимая для отрывания электрона от нейтрального атома. Она характеризует восстановительную способность элемента. Чем меньше значение энергии ионизации, тем более сильным восстановителем является элемент. В периодах (слева – направо) энергия ионизации увеличивается, но её увеличение идёт не равномерно. В подгруппах (сверху – вниз) энергия ионизации увеличивается. Энергия сродства к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому. Это свойство характеризует окислительную способность элемента. Чем больше значение сродства, тем больше выражены окислительные свойства элемента.
В периодах (слева – направо) энергия сродства к электрону увеличивается, не монотонно, максимум смещен на один элемент влево по сравнению с энергией ионизации. В подгруппах (сверху – вниз) энергия сродства к электрону уменьшается. Электроотрицательность (ЭО)– характеризует способность атома элемента удерживать электроны свои собственные и принятые.
ЭО может быть вычислена полусуммой энергии ионизации и сродства. Относительная ЭО показывает металлический или неметаллический характер элемента. Чем выше ЭО, тем сильнее выражены неметаллические свойства.В периодах (слева – направо) ЭО увеличивается. В подгруппах (сверху – вниз) ЭО уменьшается. Расстояния от ядра до максимума электронной плотности внешней орбитали атома или иона определяют атомный или ионный орбитальный радиусы, которые указывают на размеры атома или иона в свободном состоянии, т. е. до образования ими химической связи.
5.Окислительно-восстановительные и кислотно-основные свойства элементов и веществ.
Химическая связь и строение молекул.В периодах с увеличением порядкового номера элемента окислительные свойства возрастают, восстановительные – уменьшаются. В группах с увеличением порядкового номера окислительные свойства ослабевают, а восстановительные – усиливаются. По окислительно – восстановительной активности различают: 1.Вещества – типичные восстановители -Это металлы ( с зарядом 0), вещества, которые содержат элементы в нисшей степени окисления (Zn, H2S, HCl – не могу принимать электроны); 2.Вещества – типичные окислители -Это вещества, которые содержат элементы в высшей степени окисления (Na2SO4, HClO4 – могут только отдавать электроны); 3.Вещества – окислительно – восстановительная двойственность -Эти вещества содержат элементы в промежуточной степени окисления (Cl, S, Na2SO3).
