Тема 3: Строение и свойства атомов
Атом – наименьшая частица химического элемента, носитель всех его химических свойств. Он представляет собой электронейтральную систему, состоящую из положительно заряженного ядра и отрицательно заряженных электронов. Ядро составляет основу атома. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу.
Согласно теории квантовой механики, электрон наряду со свойствами вещества (частицы), обладает и свойствами электромагнитного поля (двойственная корпускулярно-волновая природа).
Движение электрона в атоме носит вероятностно-волновой характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). Занимая ту или иную АО, электрон образует электронное облако.
Для характеристики движения электрона в атоме используют 4 квантовых числа:
n – главное квантовое число, характеризует энергию электронов, размер электронного облака, расстояние электронов от ядра n=1,2,3…
l – орбитальное квантовое число, характеризует форму распределения электронного облака (форму орбитали) l = от 0 до (n – 1)
ml – магнитное квантовое число, характеризует пространственную ориентацию электронного облака относительно внешнего магнитного поля ml = -l…0…+l
ms – спиновое квантовое число, характеризует собственное вращение электрона ms = +1/2; -1/2.
Основные принципы размещения электронов в атоме:
1. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковыми все четыре квантовых числа n, l, m, s.
2. Принцип наименьших энергий. Устойчивому состоянию электронов в атоме соответствует минимум энергии.
Следствие: энергоемкие подуровни заполняются в порядке увеличения их энергии
3. Правило Хунда (Гунда). В пределах подуровня распределение электронов происходит таким образом, чтобы суммарный спин был максимальным.
Следствие: В пределах подуровня электроны размещаются сначала по одному на орбитали, а затем уже по два.
4. Правило Клечковского. С ростом атомного номера элемента электроны размещаются последовательно на орбиталях, характеризующихся возрастанием суммы (n+l). При одинаковых значениях этой суммы раньше заполняется подуровень с меньшим значением главного квантового числа.
Последовательность заполнения подуровней всех элементов происходит в следующем порядке:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < (5d’) < 4f < 5d2-10 < <6p < 7s < 6d1 < 5f < 6d2-10
Строение электронных оболочек атомов тесно связано с периодической системой элементов Д.И. Менделеева. Номер периода равен количеству энергетических уровней. В зависимости от того, на какой энергетический подуровень в атоме поступает последний электрон, элементы делятся на s-, p-, d- и f- элементы.
При этом s – элементы составляют I и II главные подгруппы периодической системы (а также Н и Не); р – элементы с III и VIII главные подгруппы; d – элементы составляют побочные подгруппы периодической системы.
Свойства элементов тесно связаны со строением их атомов.
Периодическая повторяемость свойств элементов обусловлена периодическим повторением сходных электронных группировок атомов. Например, все атомы элементов I главной подгруппы имеют одинаковую электронную конфигурацию ns1, а VIII главной подгруппы ns2np6.
Химическая природа элемента обуславливается способностью его атома отдавать или приобретать электроны. Эта способность может быть количественно оценена энергией ионизации атома (мера металлических свойств элементов) или сродством к электрону (мера неметаллических свойств).
Наиболее полную характеристику металлических и неметаллических свойств элементов, а также способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения дает величина, называемая электроотрицательностью (ЭО). Чем больше эта величина, тем в большей степени элемент проявляет неметаллические свойства. Наибольшей ЭО обладает F(4,0), наименьшей – Cs, Fr (0,7).
В пределах главных подгрупп сверху вниз ЭО уменьшается – увеличиваются металлические свойства элементов, основные свойства гидроксидов и восстановительные свойства соответствующих соединений.
В периодах слева направо происходит постепенное уменьшение металлических и нарастание неметаллических свойств.
Пример 1. Элемент – бром.
а) В каком периоде, группе, подгруппе находится элемент?
б) Каков состав ядра наиболее распространенного изотопа элемента?
в) Сколько электронов у атомов этого элемента? Дайте распределение электронов по энергетическим уровням, подуровням, орбиталям в нормальном и возбужденном состояниях.
г) Укажите максимальную валентность этого элемента. К какому электронному семейству он относится?
д) Является этот элемент металлом или неметаллом?
Решение:
а) Химический элемент бром (Br) находится в четвертом периоде, в седьмой группе, главной подгруппы, порядковый номер 35.
б) В природном броме 50,51 % изотопа 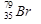 и 49,49% изотопа
и 49,49% изотопа 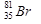 (искусственно получены еще 13 изотопов).
(искусственно получены еще 13 изотопов).
Состав ядра изотопа 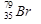 : протонов – 35, нейтронов – 44.
: протонов – 35, нейтронов – 44.
Число нейтронов (N) определяется по формуле:
N = A – Z,
где А – массовое число (верхний индекс химического символа ядра); Z – число протонов в ядре, определяющее заряд ядра.
в) Число электронов в атоме равно заряду ядра; в данном случае число электронов равно 35.
Используя правило последовательности заполнения атомных орбиталей (принцип Паули, правила Хунда и Клечковского), напишем электронную формулу атома брома и дадим распределение электронов по орбиталям в нормальном и возбужденном состояниях:
1s22s22p23s23p63d104s24p5
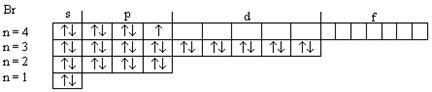
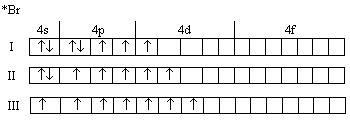
I, II, III, - возбужденные состояния атома Br
г) Максимальная валентность брома – 7. Из электронной формулы следует, что бром относится к семейству р – элементов (последним в его атоме заполняется р – подуровень), поэтому он находится в главной подгруппе.
д) Бром – типичный неметалл, так как в его атоме до завершения внешнего энергетического уровня не достает одного электрона.
Контрольные задания:
41 – 60.а) В каком периоде, группе, подгруппе находится элемент А?
б) Каков состав ядра наиболее распространенного изотопа элемента А?
в) Сколько электронов у атомов этого элемента? Дайте распределение электронов атомов элемента А по энергетическим уровням, подуровням, орбиталям в нормальном и возбужденном состояниях.
г) Укажите максимальную валентность этого элемента. К какому семейству (s - , p -, d – или f - ) относится этот элемент?
д) Является этот элемент металлом или неметаллом?
