Суммируя уравнение анодного и катодного процессов, получаем
Fe0 + Cu2+ = Fe2+ + Cu0
В молекулярной форме:
Fe + CuSO4 = FeSO4 + Cu – токообразующая реакция.
ЭДС гальванического элемента равна:
Dj = jк – jа = 0,281 – (–0,44)=0,721 В.
Во внешней цепи электроны переходят с анода на катод, а во внутренней сульфат-ионы от катода движутся к аноду.
Электрохимическая схема гальванического элемента:
ē
 |

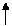 А(-) Fe / FeSO4 // CuSO4 / Cu (+) K
А(-) Fe / FeSO4 // CuSO4 / Cu (+) K
 0,01М
0,01М
SO42-
Методика рассмотрения работы гальванических элементов:
Гальванический элемент с металлическими электродами. Металлы разной активности.
1. Составляют схему гальванического элемента.
(А) - Me1 / Me1n + // Me2 m+ / Me2 + (К)
2. По уравнению Нернста находят потенциалы электродов:
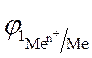 =
= 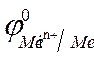 +
+ 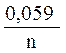 · lg
· lg 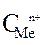
3. Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом.
4. Записывают уравнения электродных процессов, определяют характер этих процессов.
5. Составляют суммарные ионное и молекулярное уравнения окислительно-восстановительной реакции, протекающей в гальваническом элементе.
6. Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ И РАСТВОРАМИ ЩЕЛОЧЕЙ И КИСЛОТ
Взаимодействие металлов с растворами кислот
При взаимодействии с водными растворами кислот металлы проявляют типичные для них восстановительные свойства, кислоты выступают в качестве окислителей. Они делятся на две группы:
· кислоты, окислителем в которых является ион водорода (НСl, HBr, HI, разбавленная H2SO4 и др.);
· кислоты, окислителем в которых выступают анионы, содержащие элементы в высшей степени окисления. Это концентрированная и разбавленная азотная, концентрированная серная, хлорная (окислители – анионы: SO42-, NO3-, ClO4-) и другие кислоты.
Для протекания любого окислительно-восстановительного процесса необходимо выполнение условия: окислительно-восстановительный потенциал окислителя должен быть больше потенциала восстановителя (jок > jвос, Dj = jок - jвос > 0). В соответствии с этим условием в кислотах первой группы (окислитель – ион водорода, j02Н+/Н2=0 В) взаимодействуют только металлы, характеризующиеся отрицательным стандартным потенциалом. Это металлы, стоящие в ряду стандартных электродных потенциалов металлов (ряд напряжений, вытеснительный ряд) до водорода.
Взаимодействие металлов с концентрированной серной
Кислотой
В концентрированной серной кислоте окислителем является S+6, поэтому ни один металл из концентрированной H2SO4 водород (H2) не вытесняет. Продукты реакции зависят от активности металла.
Предлагается схема взаимодействия H2SO4 конц. с металлами разной активности.
–2
  акт. Me акт. Me | соль + H2O + H2S↑ | |
| +6 | cр. акт. Me | |
 Me0 + H2SO4 конц. Me0 + H2SO4 конц. |  | соль + H2O + S0↓ |
| Red Ox | мало акт. Me | +4 |
 | соль + H2O + SO2↑ | |
Ряд активности металлов можно разбить на следующие группы:
1. Активные металлы - [Li………Al]
2. Металлы средней активности [Mn……..Pb]
3. Малоактивные металлы [Cu…….Au]
