Хід роботи. В мірній колбі на 100 мл готують розчин ПАР (речовину і вихідну концентрацію задає викладач)
В мірній колбі на 100 мл готують розчин ПАР (речовину і вихідну концентрацію задає викладач). Методом розведення (1:2) готують 8 – 10 водних розчинів ПАР.
Для вимірювання поверхневого натягу використовують метод Ребіндера. В основі методу лежить вимірювання тиску, при якому відбувається відрив газового пухирця, що видувається із капіляра в рідину. Схема установки наведена на рис. 3.
Прилад складається із вимірювальної чарунки 4 в якій знаходиться капіляр 3, аспіратора 1 для створення надлишкового тиску, і мікроманометра 8. Манометри можуть бути похилі, як наведено на рисунку або U- подібні.
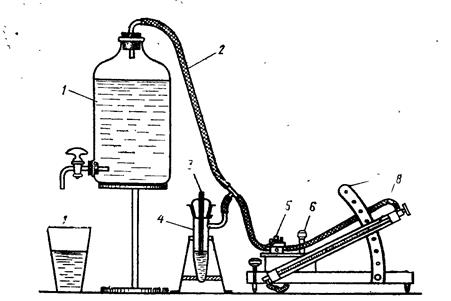
Рис. 3. Схема установки для визначення поверхневого натягу методом Ребіндера. 1 – аспіратор; 2 – з’єднувальна трубка; 3 – капіляр; 4 – чарунка, 5 трохходовий кран; 6 - регулятор рівня манометричної рідини; 7 – кронштейн; 8 – манометрична трубка
Для визначення поверхневого натягу використовують відносний метод. Для цього знаходять сталу капіляра (чарунки) k, яку визначають за значенням максимального тиску Dрводи і поверхневого натягу sводи :
k = sводи/Dрводи (9)
де sводи - поверхневий натяг води взятий із довідника при температурі досліду; Dрводи - різниця висот манометричної рідини U - подібного манометра.
Визначивши сталу k і вимірявши тиск Dрмакс для досліджуваного розчину, розраховують значення
sрозчину = kDрмакс. (10)
Вимірювання Dрмакс проводять наступним чином. Досліджувану рідину наливають в чарунку 4 до рівня, при якому кінчик капіляра 3 занурюється в неї не більше ніж на 1 мм. При зануренні капіляру в рідину, (його контакті із рідиною) утворюється меніск кругом кінчика капіляра це і є достатною глубиною його занурення. Чарунку закріплюють в штативі у вертикальному положенні, з’єднують відвідною гнучкою трубкою 2 з аcпіратором 1 і краном 5 мікроманометра. Для створення зрідження у чарунці відкривають кран аспіратора 1 і добиваються викапування рідини в склянку приблизно 20-30 крапель в хвилину. Пухирець повітря, що формується на кінчику капіляра 3 при досягненні Dрмакс, відривається від капіляра і спливає на поверхню рідини тріскаючи при цьому. В цей момент тиск в системі знижується і манометрична рідина опускається на максимальне значення рівне рмакс. При формуванні нового пухирця рідина поступово опускається знову до максимального значення р. Рівень рідини в манометричній трубці весь час коливається досягаючи в момент відриву пухирця максимального значення. Якщо покази манометра на протязі 2-3 хв не змінюються, то ці значення вважають рівноважними і записують в таблицю. Dрмакс визначають віднявши від початкового значення р0 манометричної рідини рмакс.
Результати вимірювань заносять в табл. 1 чи табл. 2 в залежності від завдання.
Таблиця 1
Результати вимірювання поверхневого натягу та розрахунків
| № колби | ||||||||||
| Концентрація розчину ПАР,% | ||||||||||
| Концентрація розчину ПАР, М | ||||||||||
| Dh, мм | ||||||||||
| s, мДж/м2 | ||||||||||
| Ds/Dс |
За отриманими експерементальними даними будують графік залежності s=f(с) (див. рис. 1), визначають Ds/Dс на різних ділянках ізотерми.
В табл. 2 заносять результати експериментальних визначень у випадку, коли виконують завдання 2.
За отриманими експерементальними даними будують графік залежності s=f(с) (див. рис. 1), проводять його диференціювання одним із описаних вище методів (визначають Ds/Dс на різних ділянках ізотерми).
За формулою (2) обчислюють адсорбцію для різних рівноважних значень концентрації ПАР. При диференціюванні за допомогою дотичних за с приймають значення, яке відповідає точці дотику дотичної до ізотерми s - с, при методі трикутників за с приймають середину прилеглого катета. По одержаних даних будують ізотерму адсорбції Г = f(c) звідки визначають значення граничної адсорбції Г¥ та за формулами (7, 8) обчислюють молекулярні характеристики ПАР в адсорбційному шарі S0 та d.
Таблиця 2
Результати вимірювання поверхневого натягу та розрахунків
| № колби | ||||||||||
| Концентрація розчину ПАР, % | ||||||||||
| Концентрація розчину ПАР, моль/л | ||||||||||
| Dh, мм | ||||||||||
| s, мДж/м2 | ||||||||||
| Ds/Dс | ||||||||||
| Рівноважна концент-рація ПАР, моль/л | ||||||||||
| Адсорбція Г, моль/м2 | --+ |
Звіт лабораторної роботи повинен містити короткі теоретичні відомості, методичну частину, основні розрахункові формули, приклади розрахунків, висновки. Отримані експерементальні результати потрібно навести у вигляді таблиць та графіків.
Завдання І:1).Дослідити залежність поверхневого натягу водних розчинів молекулярних ПАР від концентрації.
2). Побудувати ізотерму поверхневого натягу.
3). Визначити поверхневу активність ПАР (формула 3).
Завдання ІІ:1).Дослідити залежність поверхневого натягу водних розчинів колоїдних ПАР від концентрації.
2). Побудувати ізотерму поверхневого натягу (рис. 1).
3). Визначити поверхневу активність ПАР (рівняння 3).
4). По даних ізотерми поверхневого натягу побудувати ізотерму адсорбції ПАР (рис. 2).
5). Визначити граничну адсобцію ПАР на межі розділу розчин – газ.
6. Обчислити площу молекули ПАР, яку вона займає на поверхні водної фази (рівняння 7).
7). Обчислити довжину вуглеводневого радикалу ПАР (рівняння 8).
Для підготовки до виконання роботи познайомтеся із задачами із відповідного розділу с.____________- [8] та ______________[10]
Контрольні запитання
1. Дайте визначення поверхневого натягу.
2. Які речовини називаються поверхнево-активними?
3. На які класи поділяються поверхнево-активні речовини?
4. В чому полягає різниця між молекулярними поверхнево-активними речовинами та колоїдними поверхнево-активними речовинами?
5. Що лежить в основі поділу ПАР на класи?
6. На які групи поділяються колоїдні поверхнево-активні речовини?
7. Який фізичний зміст рівняння Гібса для адсорбції ПАР?
8. Дайте визначення поверхневої активності.
9. В чому суть правила Дюкло – Траубе?
10. Якого максимального значення може набути поверхневий натяг розчину етилового спирту у воді?
11. За рахунок чого неіоногенні ПАР проявляють високу поверхневу активність?
12. Опишіть ізотерму поверхневого натягу водних розчинів колоїдних ПАР.
13. Поясніть взаємозв’язок між ізотермою поверневого натягу та ізотермою адсорбції.
14. Перелічіть методи визначення поверхневого натягу.
15. В чому суть методу максимального тиску бульбашки (методу Ребіндера)?
16. Чому дорівнюватиме поверхневий натяг на межі розділу рідина – рідина?
17 Як визначити граничну адсорбцію речовини?
18. Які геометричні характеристики молекул ПАР можна отримати із досліджень впливу концентрації ПАР на значення поверхневого натягу розчинів.
19. Розкрийте фізичний зміст рівняння Шишковського?
