Сущность и классификация методов осадительного титрования
Метод объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. В этих целях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.
Наименования отдельных методов осаждения происходят от названий применяемых титрантов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов С1- и Вг- в нейтральных или слабощелочных средах.
Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов Сl- и Br-, но уже в сильнощелочных и кислых растворах. Используют ее и для определения содержания серебра в рудах или сплавах.
Дорогостоящий аргентометрический метод определения галогенов постепенно вытесняется меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2 (NO3)2
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Сущность аргентометрического метода осаждения»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А.
Проверил: преподаватель Воболис О.Н.
г.Надым 2013
Аргентометрия
Объемный аналитический метод, основанный на реакциях осаждения ионов галогенов катионами серебра с образованием малорастворимых галогенидов:
Cl-+Ag+= AgCl↓
При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).
Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора).
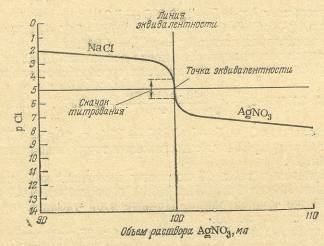
Рисунок 2.1 – Кривая титрования раствора NaCl раствором AgNO3
До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-]=l0-1.
Обозначив отрицательный логарифм концентрации (или активности) определяемых хлорид-ионов через рСl, можно написать:
рCl = – lg [Cl-] = – lg l0-1= 1.
Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 10-2 моль/л, а рС1 будет равен 2. Поскольку же величина ПPAgCl=10-10, концентрация ионов серебра при этом составит:
[Ag+] = 10-10/[С1-] = 10-10/10-2 = 10-8 моль/л,
или pAg= – lg[Ag+] = – lgl0-8 = 8.
Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= 5 (см. табл. 2.1).
Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от значения произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка.
Индикатор метода Мора – раствор К2СгО4 дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но растворимость осадка (0,65*10-4Э/л) гораздо больше растворимости хлорида серебра (1.25*10-5 Э/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии довольно ограничены. Её используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). В кислой среде осадок хромата серебра растворяется.
В сильнощелочных растворах нитрат серебра разлагается с выделением нерастворимого оксида Ag2O. Метод непригоден и для анализа растворов, содержащих ион NH4+, так как при этом образуется с катионом Ag+ аммиачный комплекс [Ag(NH3)]+. Анализируемый раствор не должен содержать Ва2+, Sr2+, Pb2+, Bi2+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих С1 – – ионы. Растворы, содержащие Ag+, не выливают в раковину, а собирают в специальную склянку, так как серебро из них регенерируют.
Кроме метода Мора при определении хлоридов аргентометрическим титрованием применяется также метод Фаянса. Он основан на прямом титровании растворов содержащих галогенид ионы стандартным раствором AgNO3 в присутствии адсорбционных индикаторов:
Ag+ + Cl-→ AgCl
mAgCl + n Ag+(изб)→ (AgCl)mAg+n
(AgCl)mAgn+ + Ind- → [(AgCl)mAg+n] Ind-
Титрование хлоридов в присутствии флуоресцеина проводят в нейтральной среде. При повышенной концентрации ионов водорода флуоресцеин, являющийся кислотой (HInd), диссоциирует слабо вследствие подавления его диссоциации кислотой. Поэтому концентрация Ind-ионов становится очень малой. В щелочном растворе осаждается Ag2O. В умеренно кислой среде обычно титруют в присутствии других индикаторов: дихлорфлуоресцеина и эозина. Титрование в кислых средах выгодно отличается от титрования в нейтральных растворах, так как дает возможность вести определение в присутствии гидролизующихся солей, разлагающихся водой с образованием осадков гидроокисей и оксихлоридов (Al3+, Fe3+ и др.).
В мерную колбу и вносят аликвоту пробы. После чего доводят объем раствора до метки и тщательно перемешивают. Для определения хлорида отбирают аликвотные части исследуемого раствора (по 25 мл), переносят их в конические колбы, прибавляют по 5 капель раствора флуоресцеина и титруют стандартным раствором AgNO3, непрерывно перемешивая. По мере прибавления по каплям раствора AgNO3 титруемая смесь мутнеет. Вблизи точки эквивалентности наблюдается частичная коагуляция коллоидного осадка AgCl. В этот момент титруют еще более внимательно и осторожно, сильно перемешивая содержимое колбы, титрование заканчивают, когда белый осадок AgCl окрашивается в красный цвет. Титрование выполняют 3 – 4 раза и, получив три сходящихся результата, вычисляют результаты анализа.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Сущность тиоцианатометрического метода осаждения»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А.
Проверил: преподаватель Воболис О.Н.
г.Надым 2013
Роданометрия
Роданометрический метод (метод Фольгарда) титриметрического анализа основан на применении в качестве осадителя титрованного раствора, содержащего SCN--ионы:Ag+ + SCN- → AgSCN
В качестве стандартных растворов используют: для определения ионов роданид аммония; для определения галогенидов и других ионов – нитрат серебра и роданид аммония.
Роданометрическим методом пользуются для определения галоген-ионов и серебра в серебряных сплавах. В роданометрии в качестве индикатора для определения точки эквивалентности. применяют насыщенный раствор железо-аммонийных квасцов.
Метод Фольгарда обладает рядом достоинств по сравнению с методом Мора. Роданометрический метод применим для определения хлоридов, бромидов, иодидов, роданидов и ионов серебра.
Метод применим для титрования кислых растворов так как осадок AgSCN нерастворим в кислотах. Эта особенность метода делает очень удобным при анализе серебряных сплавов, которые растворяют в кислотах, и количественном определении галогенидов в сильнокислых средах, так как галогениды в указанных средах нельзя титровать по методу Мора или в присутствии адсорбционных индикаторов. Другие ионы (Ва2+, РЬ2+ и др.), мешающие определению по методу Мора, в большинстве случаев не мешают определению по методу Фольгарда.
Определение С1--ионов по методу Фольгарда основано на применении метода обратного титрования. Хлорид-ионы сначала осаждают определенным объемом стандартного раствора AgNO3, взятого с избытком. Затем оттитровывают не вступивший в реакцию с хлоридом избыток AgNO3 стандартным раствором NH4SCN в присутствии железо-аммонийных квасцов в качестве индикатора. По разности результатов двух титрований определяют объем раствора AgNO3, израсходованного на осаждение С1- Таким образом, последовательно протекают три реакции:
Ag+ + Cl- → AgCl
Ag+ + SCN- → AgSCN
3 SCN- + Fe3+ → Fe(SCN)3
Однако в тот момент, когда избыток Ag+ будет оттитрован роданидом, избыток SCN – вступает, кроме того, в реакцию с AgCl:
AgCI+ SCN- ↔ AgSCN + Сl-
Так как роданид серебра (ПPAgSCN = 10-12) менее растворим, чем хлорид серебра (ПPAgCl=. 1,7*10-10), то указанное равновесие сдвигается слева направо.
В момент равновесия отношение [C1-]/[SCN-] равно отношению ПPAgCl/ПPAgSCN. Следовательно:
[Cl-]/[SCN-] = ПPAgC/ ПPAgSCN = = 170
равновесия:
[Сl-] = моль/л
Следовательно, в точке эквивалентности при избытке SCN- и установившемся равновесии [SCN-] = 1,3*10-5: 170 = 8*10-8 моль/л.
Таким образом, равновесие установится тогда, когда практически весь избыток SCN – вступит в реакцию двойного обмена с AgCl. Поэтому конечную точку титрования трудно заметить, так как появившееся розово-красное окрашивание, вызываемое образованием Fe(SCN)3, быстро исчезает вследствие обменной реакции:
Fe(SCN)3 + 3AgCl → Fe3+ + ЗСl- + 3AgSCN
Для предупреждения этой реакции применяют различные способы. Наиболее эффективно отделение осадка AgCl фильтрованием. При этом С1- ионы осаждают избытком раствора AgNO3 в мерной колбе, доводят объем раствора до метки, смесь взбалтывают 5–10 мин и отфильтровывают по частям через сухой фильтр. Первые порции фильтрата отбрасывают. Аликвотные части фильтрата (25 мл из 250 мл) титруют роданидом.
Для проведения анализа по методу Фольгарда, берут 100 см3 раствора. Титрованные растворы нитрата серебра и роданида аммония помещают в две различные бюретки. Отбирают из мерной колбы в коническую колбу аликвотное количество раствора, добавляют 2 капли азотной кислоты, 1 мл раствора индикатора и прибавляют отмеренный избыток раствора нитрата серебра (50 мл). Затем приступают к титрованию полученной смеси титрованным раствором роданида аммония до появления красного окрашивания раствора. Определение повторяют до тех пор, пока результаты трех титрований будут расходиться не более чем на 0,05 мл.
В случае необходимости выпавший осадок отфильтровывают или добавляют в анализируемый раствор бензол и ведут определение, как указано выше.
При известном навыке определение не занимает много времени и приводит к достаточно точным результатам.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Сущность меркурометрического метода осаждения»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А. Проверил: преподаватель Воболис О.Н.
г.Надым 2013
Меркурометрический метод титриметрического анализа основан на применении титрованных растворов солей ртути(I) (меркуро-ионов).
При взаимодействии [Hg2]2+-ионов с хлоридами, бромидами, иодидами и т.д. образуются осадки малорастворимых галогенидов Hg2Cl2, Hg2Br2, Hg2I2, например:
[Hg2]2+ + 2Сl- → Hg2Cl2
Меркурометрический метод по сравнению с аргентометрическим дает некоторые преимущества.
1. При меркурометрическом методе не требуется ценных препаратов серебра.
2. Соли ртути (I) менее'растворимы, чем соответствующие соли серебра, и поэтому при титровании хлоридов нитратом ртути(I) наблюдается резкий скачок титрования вблизи точки эквивалентности.
3. Определение меркурометрическим методом можно проводить в кислых растворах методом прямого титрования.
Недостатком меркурометрического метода является ядовитость солей ртути. Поэтому при работе с этими солями следует соблюдать большую осторожность.
Применение меркурометрического метода при количественных определениях растворимых хлоридов и бромидов пока ограничено.
В меркурометрическом методе титрования в качестве индикаторов применяют:
Дифенилкарбазон, образующий с [Нg2]2+-ионами осадок синего цвета.
Роданид железа Fe(SCN)3. При титровании (например, хлоридов) растворами солей ртути(I) в точке эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов реагирует с Fe(SCN)3 по уравнению:
3 [Hg2]2+ + 2 Fe(SCN)3 → 3Hg2(SCN)2 + 2Fe3+
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Сущность меркуриметрического метода осаждения»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А.
Проверил: преподаватель Воболис О.Н.
г.Надым 2013
Метод основан на применении в качестве титранта раствора солей ртути (II). При взаимодействии Hg2+ с хлорид ионами образуется слабо диссоциированное соединение:
Hg2+ + Cl- → [HgCl]+
После достижения точки эквивалентности, в титруемом растворе появляются избыточные Нg2+-ионы, которые обнаруживают при помощи соответствующего индикатора, образующего с Hg2+ характерные соединения.
В качестве стандартных растворов для определения галогенидов, цианидов и роданидов применяют нитрат или перхлорат ртути(II), а для определения ионов хорошо диссоциирующих солей ртути – роданид аммония.
В меркуриметрии в качестве индикаторов применяют нитропруссид натрия, дающий бесцветный осадок с Hg2+, дифенилкарбазон, образующий синий осадок, р-нитрозо-нафтол, внутрикомплексное соединение которого с Hg2+ красного цвета. И.С. Мустафин и О.В. Сиванова в 1964 г. предложили для этой же цели применять нитрозооксин в смеси с красителем кислотным синим антрахиноновым; последний прибавляется в качестве светофильтра. Такой индикаторный раствор, названный авторами гидрон III, при избытке галогенидов окрашен в зеленый цвет, переходящий в красный при избытке Hg2+. Индикатор позволяет работать с 2,5*10-3 н. раствором Hg2+ и определять, например, 0,03 мг хлоридов в 10 мл титруемого раствора.
Меркуриметрический метод широко применяется благодаря многим преимуществам по сравнению с аргентометрическими методами.
1. Меркуриметрический метод позволяет вести прямое определение анионов в кислой среде.
2. Этот метод применяется не только для определения галогенидов, цианидов и роданидов, но и для определения ионов окисной ртути.
3. Многие ионы, мешающие определению по методу Мора и Фольгарда, не оказывают влияния на точность определений с помощью нитрата или перхлората окисной ртути.
4. Соединения ртути являются менее дефицитными, чем соли серебра, и легко регенерируются.
Меркуриметрическое определение хлоридов выполняется методом прямого титрования анализируемого раствора раствором нитрата ртути (ІІ) в присутствии индикатора нитропруссида натрия или дифенилкарбазона. Титрование ведётся до появления сине-фиолетового окрашивания.
Меркуриметрический метод, равно как и другие методы, основанные на применении солей ртути, имеет весьма существенный недостаток: соли ртути ядовиты, работа с ними требует большой аккуратности и применения необходимых мер предосторожности.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Факторы, влияющие на скорость окислительно-восстановительных реакций»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А.
Проверил: преподаватель Воболис О.Н.
г.Надым 2013
Когда на экзамене абитуриента просят перечислить факторы, влияющие на скорость химической реакции, то обычно ожидают такого ответа:
- природа реагирующих веществ,
- концентрация реагентов,
- температура,
- наличие катализатора.
** На самом деле этот перечень шире: мы уже знаем, что на скорость гетерогенных реакций сильное влияние оказывает площадь поверхности раздела фаз и диффузия. Однако полезно обобщить перечисленные выше четыре фактора, понимая при этом, что они имеют отношение главным образом к гомогенным реакциям.
Под влиянием природы реагирующих веществ обычно подразумевают то простое обстоятельство, что разные вещества реагируют по-разному. Это тривиальное наблюдение можно сделать более ценным, если анализировать примеры разной реакционной способности сходных по строению веществ в однотипных реакциях. Например, реакция газообразного иодистого водорода с кислородом при комнатной температуре идет с заметной скоростью:
4 HI + O2 = 2 H2O + 2 I2
Аналогичная реакция газообразных HCl и O2 с образованием хлора и воды при комнатной температуре идет очень медленно. Обе реакции – окислительно-восстановительные и для их протекания атом галогена в молекулах HCl или HI должен передать электрон кислороду (убедитесь в этом, расставив степени окисления над атомами в уравнении реакции). Иод в молекуле HI – более подходящий донор электрона, т.к. его валентная оболочка находится существенно дальше от ядра, чем у атома хлора в молекуле HCl. Таким образом, знание электронного строения атомов и молекул реагирующих веществ часто позволяет качественно оценить относительные скорости некоторых реакций. Также под природой реагирующих веществ иногда могут подразумевать степень их раздробленности в гетерогенных реакциях.
Влияние концентрации реагентов на скорость реакций мы уже достаточно подробно обсудили – кинетические уравнения количественно учитывают этот фактор.
Что касается влияния температуры, то этот фактор действует одинаково как на скорость реакции v, так и на константу скорости k – обе эти величины быстро возрастают с повышением температуры. Полезно рассмотреть влияние температуры именно на константу скорости – в этом случае нашу задачу не осложняют постоянно меняющиеся в ходе реакции концентрации реагирующих веществ.
Еще в XIX веке голландский физикохимик Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 оС скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
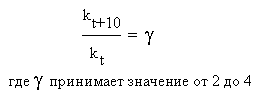
Здесь γ (греческая буква «гамма») - так называемый температурный коэффициент или коэффициент Вант-Гоффа, kt и kt+10 – константы скорости реакции при температурах t и (t + 10) оС. Для каждой конкретной реакции температурный коэффициент определяется опытным путем. Он показывает, во сколько именно раз возрастает скорость данной химической реакции (и ее константа скорости) при повышении температуры на каждые 10 градусов.
Температурные коэффициенты используют главным образом в учебной литературе – для нужд химической кинетики они мало пригодны, поскольку не сохраняют строго постоянных значений в разных интервалах температур. Но нам с вами температурные коэффициенты позволят наглядно разобраться в характере зависимости скорости реакции от температуры. Эта зависимость нелинейная, т.е. скорость реакции возрастает гораздо быстрее, чем температура.
Покажем это на примере реакции, с температурным коэффициентом γ = 2,9. Допустим, мы хотим выяснить, во сколько раз возрастет скорость реакции (и константа скорости k) при повышении температуры от 50 оС до 100 оС. Примем за единицу константу скорости при 50 оС (k50 = 1). Через 10о (т.е. при 60 оС) константа k вырастет в 2,9 раза: k60 = 2,9. Еще через 10о (при 70 оС) значение константы составит: k70 = k60.2,9 = 2,92. Так, продолжая добавлять 10-градусные интервалы, мы придем к значению k100 = 2,95. В общем случае:
k2 = k1·γn
Где n – число 10-градусных интервалов в заданном интервале повышения температуры. В нашем примере при повышении температуры от 50о до 100о таких интервалов 5. При этом мгновенная скорость реакции и константа скорости реакции возрастут примерно в 595 раз:
k2/k1 = γn = 2,95 = 595
** Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
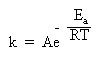
Здесь k – константа скорости, e – важное в математике число (равное приблизительно 2,71 и возникающее во многих математических преобразованиях), R – газовая постоянная, T – абсолютная температура в Кельвинах (об R и T см. в §5.6 книги 1), Ea – энергия активации. Еще одна постоянная А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Многие наши читатели пока не знакомы с логарифмами, поэтому здесь мы не будем приводить способ решения такого уравнения. Для нас сейчас важен общий нелинейный характер зависимости константы скорости k от температуры, а также характер связи между скоростью реакции и энергией активации. Если левую и правую части уравнения Аррениуса разделить на постоянную А и записать число e его приближенным численным значением, то уравнение примет вид:
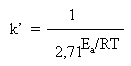
Напомним, что Ea – величина примерно постоянная для каждой реакции, не зависящая от температуры. В полученном выражении она входит в показатель степени при 2,71. Чем больше Ea конкретной реакции, тем больше будет знаменатель дроби и тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Если же рассматривать какую-нибудь одну реакцию (с фиксированной Ea) при разных температурах, то повышение Т быстро уменьшает нижнюю часть дроби и, следовательно, измеряемая k будет быстро расти.
Повышение температуры приводит к быстрому увеличению числа "энергичных" молекул, способных преодолевать активационный барьер Ea. При прочих равных условиях чем выше барьер Ea, тем меньше скорость реакций. Многие (даже энергетически выгодные, экзотермические реакции) могут идти с заметной скоростью лишь в очень жестких условиях именно из-за высокой энергии активации. К таким реакциям, например, относится получение аммиака NH3 из азота и водорода. Аммиак является важнейшим сырьем для производства многих химических продуктов. Задачу его синтеза (как и синтеза множества других полезных соединений) позволяет решить применение катализаторов - веществ, способных понижать энергию активации реакции Ea. Катализаторы не расходуются в ходе реакции, поэтому достаточно сравнительно небольшого их количества для переработки большой массы реагентов. Значительное повышение скорости реакций под влиянием таких веществ называется катализом.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЕГАЗОВЫЙ УНИВЕРСИТЕТ»
ФИЛИАЛ В Г.НАДЫМЕ ИМ. В.В.РЕМИЗОВА
Реферат
на тему: «Сущность гравиметрического анализа»
по предмету аналитическая химия
Выполнила: студентка группы ООСт-10 Байрамова А.
Проверил: преподаватель Воболис О.Н.
г.Надым 2013
