Классификация методов анализа по способу титрования
Титриметрический анализ: прямое, обратное и косвенное титрование.
Сущность прямого титрования заключается в постепенном прибавлении титранта непосредственно к раствору анализируемого вещества до достижения точки эквивалентности.
Сущность обратного титрования заключается в добавлении к анализируемому раствору точно известного избытка титранта с последующим определением его остатка, не вступившего в реакцию, с помощью второго титранта.
Сущность косвенного титрования заключается в добавлении к анализируемому веществу избытка реагента, вступающего с ним в реакцию, с последующим определением количества продукта реакции путем титрования.
43. Сущность метода кислотно-основного титрования. Основные реакции и титранты метода. Ацидиметрия, алкалиметрия. Кислотно-основные индикаторы.
В основе метода кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с ионами гидроксила, сопровождающаяся образованием слабодиссоциированных молекул воды (растворителя):
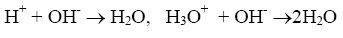
Этот метод применяется для количественного определения кислот (H2SO4, НNО3, НСl, H3PO4, СН3СООН, Н2С2O4 и др.), гидроксидов (КОН, NaOH, Ba(OH)2 и др.), солей, способных гидролизоваться в водных растворах (Na2CО3, К2СО3), а также их смесей (смесь NH4Cl и NaOH) и т. п.
Кислотно-основное титрование имеет два основных метода: ацидиметрия - определение оснований и алкалиметрия - определение кислот.
В качестве рабочих растворов используют чаще всего растворы кислот соляной и серной, растворы гидроксидов NaOH и КОН. Чаще всего применяют 0,1—0,5 н. растворы.
В качестве исходных веществ для установления титра растворов кислот используют тетраборат натрия или карбонат натрия безводный, а для установления титра растворов щелочей - щавелевую Н2С2O4 · 2H2O или янтарную Н2С2H4O4 кислоту.
При данном методе точка эквивалентности может лежать в нейтральной (рН = 7), щелочной (рН > 7) и кислой среде (рН < 7).
Различают следующие случаи титрования:
Титрование сильной кислоты сильной щелочью:
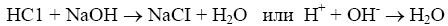
Образующаяся соль — хлорид натрия — не подвергается гидролизу, и раствор будет иметь нейтральную реакцию. Следовательно, и в растворе появляется избыток ионов ОН-. При титровании слабых кислот сильными основаниями точка эквивалентности не совпадает с точкой нейтральности и будет находиться в щелочной среде.
Титрование слабого основания сильной кислотой:
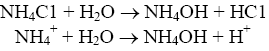
Образующаяся соль - хлорид аммония - также гидролизуется, и в растворе накапливаются ионы Н+, что смещает точку эквивалентности в кислую зону. Поэтому при титровании слабого основания сильной кислотой точка эквивалентности тоже не совпадает с точкой нейтральности. При титровании сильной кислоты сильной щелочью точка эквивалентности находится в нейтральной среде.
Титрование слабой кислоты сильной щелочью:
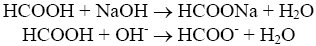
В точке эквивалентности образуется соль - формиат натрия, которая, являясь солью слабой кислоты и сильного основания, гидролизуется:
HCOONa + Н2О ↔ НСООН + NaOH
НСОО- + Н2О ↔ НСООН + ОН-
При протекании реакции нейтрализации не наблюдается каких-либо внешних признаков (эффектов), которые можно было бы наблюдать визуально. Поэтому для фиксирования точки эквивалентности необходимо применять соответствующие индикаторы. Последние меняют окраску в зависимости от изменения величины рН раствора, вследствие чего их называют рН-индикаторами.
Для индикатора-кислоты HInd в водном растворе существует равновесие:
HInd ↔ Н+ + Ind‾
Молекулярная HInd и ионная Ind‾-формы индикатора имеют разную окраску.
Вещества, которые можно применять в качестве индикаторов, должны удовлетворять определенным требованиям:
- окраска индикатора должна быть хорошо заметной;
- цвет индикатора должен резко изменяться в небольшом интервале рН,
- изменение окраски должно быть обратимым.
