Определение активности лактатдегидрогеназы в сыворотке крови
Лактатдегидрогеназа, ЛДГ (L-лактат: НАД-оксидоредуктаза; КФ 1.1.1.27) – цитоплазматический цинксодержащий гликолитический фермент, обратимо катализирующий восстановление пировиноградной кислоты в молочную кислоту:
Пируват + НАДН(H+) ↔ Лактат + НАД+
Каждая молекула ЛДГ состоит из четырех субъединиц двух типов: Н (heart) и M (muscle), образующих 5 изоферментов: ЛДГ1 (Н4), ЛДГ2 (Н3М1), ЛДГ3 (Н2М2), ЛДГ4 (Н1М3), ЛДГ5 (М5).
Наибольшая активность отмечается в почках, печени (ЛДГ4 и ЛДГ5), сердце (ЛДГ1 и ЛДГ2), скелетных мышцах (ЛДГ5), поджелудочной железе, клетках крови. В эритроцитах уровень ЛДГ в 100 раз выше, чем в сыворотке. У детей активность фермента выше, чем у взрослых; с возрастом активность ЛДГ сыворотки плавно снижается. Повышенная активность ЛДГ в физиологических условиях наблюдается у беременных, новорожденных, а также после интенсивных физических нагрузок.
Резкое повышение содержания ЛДГ в сыворотке крови отмечается при заболеваниях печени, инфаркте миокарда и инфаркте легкого. Активность ЛДГ сыворотки крови повышается также при заболеваниях системы крови, злокачественных новообразованиях различных органов; заболеваниях почек (гломерулонефриты, пиелонефриты, инфаркт почки и т.п); остром панкреатите. Приём алкоголя и некоторых лекарственных средств (таких, как кофеин, анестетики, цефалоспорины, нестероидные противовоспалительные средства, сульфаниламиды) также могут быть причиной повышения концентрации ЛДГ в сыворотке крови.
Принцип метода
Активность ЛДГ определяют по окислению лактата в пируват. Накапливающийся в реакции НАДН(Н+) в присутствии переносчика электронов восстанавливает краситель йоднитротетразолиевый фиолетовый в красный формазан, о концентрации которого судят по оптической плотности раствора при 500 нм.
Выполнение работы (см. приложение )*
Маркируют 4 пробирки и вносят в них следующие реактивы:
| Реактивы и этапы | опыт | контроль-1 | стандарт | контроль-2 | |
| 1. | Буфер ТРИС, содержащий эмульгатор и стабилизатор (рН=8,2), мл | 0,2 | 0,2 | 0,2 | 0,2 |
| 2. | Субстрат (лактат лития), мл | 0,5 | – | 0,5 | – |
| 3. | Раствор этилендиаминтетраацетата натрия, мл | – | 0,5 | – | 0,5 |
| 4. | Сыворотка крови, мл | 0,05 | 0,05 | – | – |
| 5. | Стандартный раствор ЛДГ, мл | - | - | 0,05 | 0,05 |
| 6. | Раствор НАДН(Н+) и красителя, мл | 0,2 | 0,2 | 0,2 | 0,2 |
| 7. | Перемешивают и инкубируют при 37оC 10 минут | ||||
| 8. | Раствор соляной кислоты, мл | 3,0 | 3,0 | 3,0 | 3,0 |
| 9. | Фотометрируют против воды (l= 500 нм, толщина кюветы 1 см) | D1 | D2 | D3 | D4 |
| D1 – D2 | D3 – D4 |
*Примечание: поскольку наборы для определения ЛДГ очень дороги, проводят одно определение на группу
Расчет: 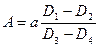 , где а – коэффициент, соответствующий активности стандартного раствора ЛДГ (4,34 мккат/л).
, где а – коэффициент, соответствующий активности стандартного раствора ЛДГ (4,34 мккат/л).
Норма: 0,66-2,66 мккат/л при 37оС.
Выводы
Тестовые задания по теме: «Биосинтез нуклеиновых кислот и белков»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
1. Дезоксинуклеотидтрифосфаты - непосредственные субстраты для синтеза ДНК.
2. Процесс транскрипции может регулироваться трийодтиронином.
3. Непосредственным донором метильной группы при синтезе ТМФ является метенил-ТГФК.
4. Все типы РНК синтезируются в ядре.
5. Биосинтез дочерних цепей ДНК осуществляется в направлении 5'3'.
6. Оксилизин и оксипролин - продукты посттрансляционной модификации соответствующих аминокислот.
7. Обеспечивается ли связывание тРНК с аминокислотами аминоацил-тРНК-синтетазами?
8. Могут ли РНК проявлять каталитическую активность?
9. Контролируется ли биосинтез РНК на матрице ДНК стероидными гормонами?
10. Может ли постсинтетическая модификация белков происходить путем фосфорилирования?
11. Различаются ли стадии элонгации в биосинтезе белков и нуклеиновых кислот?
12. Может ли происходить модификация белков путем частичного протеолиза?
2) Выбрать один правильный ответ:
| Фермент, синтезирующий аминоацил-тРНК, относится к классу: 1. трансфераз 2. лиаз 3. лигаз (синтетаз) 4. оксидоредуктаз 5. изомераз | Постсинтетическая модификация белков может происходить путем их: 1. фосфорилирования 2. гидроксилирования 3. ограниченного протеолиза 4. ковалентного связывания с простетической группой 5. всеми перечисленными способами |
3) Найти соответствие
| 1. биосинтез белка 2. синтез гема 3. синтез т-РНК | А. митохондрия Б. ядро В. рибосома |
7.6. Коллоквиум по теме: «Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белка».
Вопросы, для самостоятельной подготовки
1. Источники атомов пуринового ядра. Биосинтез аденозинмонофосфата и гуанозинмонофосфата из инозиновой кислоты.
2. Распад пуриновых нуклеотидов. Гиперурикемия и подагра.
3. Основные реакции синтеза пиримидиновых нуклеотидов.
4. Распад пиримидиновых нуклеотидов.
5. Биосинтез нуклеиновых кислот.
6. Биосинтез гема и его распад. Определение прямого и непрямого билирубина в сыворотке крови.
7. Биосинтез белка. Основные компоненты белоксинтезирующей системы. Посттрансляционная модификация белков.
8. Связь обмена углеводов, липидов и белков.
9. Примеры использования ферментов в медицине.
10. Патологические составные части мочи.
11. Основные неорганические и азотсодержащие компоненты мочи.
12. Основные химические компоненты сыворотки крови человека.
Варианты письменной части коллоквиума
| 1. Написать последовательность реакций: I. биосинтеза гема II. распада пуриновых нуклеотидов III. синтеза пиримидиновых нуклеотидов IV. распада гемоглобина 2. Указать значение количественного определения: I. мочевой кислоты II. непрямого билирубина III. креатинфосфокиназы IV. патологических компонентов мочи 3. Представить схему образования: I. дезоксирибонуклеотидов II. АТФ III. ГТФ IV. ТТФ | 4. Привести один конкретный пример использования фермента в целях: I. энзимодиагностики II. энзимотерапии III. получения лекарственных препаратов IV. количественного определения метаболитов 5. Показать схему превращения в глюкозу I. аланина II. глицерина III. пирувата IV. аспартата 6. При какой патологии и как изменяется электрофоретическая фракция белков сыворотки крови: I. альбуминов? II. α2 - глобулинов? III. β - глобулинов? IV. γ - глобулинов? |
Варианты заданий на компьютерном тестировании
| 1. Отсутствующая в составе белков аминокислота 1 аспарагиновая кислота 2 аргинин 3 лизин 4 орнитин 5 глицин 2. Повышенный уровень амилазы в моче указывает на заболевания 1 печени 2 сердца 3 легких 4 поджелудочной железы 5 кишечника 3. Синтез АТФ из АДФ в печени происходит, в основном, путем 1 реакции с ГТФ 2 окислительного фосфорилирования 3 субстратного фосфорилирования 4 взаимодействия с ФФн 5 реакции с ЦТФ 4. Железо в ретикулоцитах регулирует синтез d-аминолевулинатсинтазы на стадии 1 активации аминокислот 2 инициации трансляции 3 элонгации трансляции 4 терминации трансляции 5 на всех стадиях 5. Азот пиримидиновых оснований выводится из организма, в основном, в виде 1 мочевой кислоты 2 креатинина 3 β-аланина 4 мочевины 5 креатина 6. Лечение больных подагрой аллопуринолом (ингибитором ксантиноксидазы) вызывает 1 снижение скорости синтеза пуриновых нуклеотидов de novo 2 снижение уровня мочевой кислоты в моче 3 возрастание уровня гипоксантина в крови 4 возрастание уровня ксантина в крови 5 снижение уровня мочевины в моче 7. Активированные аминокислоты соединяются с 1 псевдоуридиловой петлей тРНК 2 кодоном мРНК 3 антикодоном тРНК 4 3'-ОН-группой рибозы концевого аденозина тРНК 5 фосфатом на 5'-конце тРНК 8. Постсинтетическая модификация белков может происходить путем их 1 фосфорилирования 2 гидроксилирования 3 ограниченного протеолиза 4 ковалентного связывания с простетической группой 5 метилирования 9. Гем входит в состав 1 амилазы 2 пероксидазы 3 пепсина 4 миоглобина 5 цитохромов 10. К буферным системам крови относятся 1 бикарбонатная 2 фосфатная 3 белковая 4 гемоглобиновая 5 глициновая 11. d-аминолевулиновая кислота синтезируется из 1 сукцинил-КоА и глицина 2 аспартата и карбамоилфосфата 3 аспартата и глицина 4 глутамата и глицина 5 ацетил-КоА и оксалоацетата 12. Веществами, из которых может образоваться мочевая кислота, являются 1 уридин 2 гуанозин 3 ксантин 4 гипоксантин 5 тимидин 13. Источником NH2-группы при синтезе АМФ из инозиновой кислоты является 1 мочевина 2 аспарагиновая кислота 3 аспарагин 4 карбамоилфосфат 5 соль аммония 14. Непосредственными субстратами для синтеза ДНК являются 1 дезоксирибоза, фосфат и нуклеиновые основания 2 фосфат и дезоксирибо-нуклеозиды 3 дезоксирибонуклеозид-трифосфаты 4 дезоксирибонуклеозиддифосфаты 5 пуриновые и пиримиди-новые основания 15. Конечный продукт катаболизма ТМФ в организме человека 1 мочевая кислота 2 b-аминоизомасляная кислота 3 инозиновая кислота 4 креатин 5 b-аланин 16. Аденин входит в состав 1 ФАФС 2 НАД+ 3 КоА 4 ПФ 5 биотина 17. Из инозиновой кислоты в организме могут синтезироваться 1 АМФ 2 ГМФ 3 ЦМФ 4 ТМФ 5 УМФ 18. УМФ может входить в 1 тРНК 2 мРНК 3 ДНК 4 рРНК 5 митохондриальную ДНК 19. Аминокислота, образующаяся в составе белков в результате их постсинтетической модификации 1 пролин 2 b-аланин 3 глицин 4 5-гидроксилизин 5 глутамин 20. Отличительными особенностями тРНК является наличие 1 антикодона 2 аденозина на 3'-конце 3 большого количества минорных оснований 4 только дезоксирибонуклеотидов 21. Процесс транскрипции может регулироваться 1 адреналином 2 норадреналином 3 кортизолом 4 вазопрессином 5 окситоцином 22. При инфаркте миокарда в сыворотке крови положительны следующие тесты 1 повышение активности аминотрансфераз 2 увеличение содержания ЛДГ1 и ЛДГ2 3 повышение активности креатинкиназы 4 увеличение активности амилазы 5 увеличение активности кислой фосфатазы 23. Патологическими компонентами мочи (в клинических анализах) не считаются 1 белок 2 кетоновые тела 3 глюкоза 4 сульфаты 5 фосфаты 24. Оротовая кислота является промежуточным продуктом синтеза 1 пуриновых нуклеотидов 2 пиримидиновых нуклеотидов 3 гема 4 холестерина 5 кетоновых тел 25. Источником NH2-групп при синтезе ГМФ из инозиновой кислоты является 1 аспарагиновая кислота 2 глутамин 3 глутаминовая кислота 4 карбамоилфосфат 5 мочевина 26. Резкое увеличение активности кислой фосфатазы в сыворотке крови указывает на поражение 1 сердца 2 мышц 3 печени 4 поджелудочной железы 5 предстательной железы 27. Непосредственным предшественником образования мочевой кислоты является 1 гипоксантин 2 ксантин 3 аденин 4 гуанин 5 инозиновая кислота 28. Конечным продуктом катаболизма УМФ является 1 мочевая кислота 2 b-аминоизомасляная кислота 3 инозиновая кислота 4 креатин 5 b-аланин 29. d-аминолевулиновая кислота является промежуточным продуктом синтеза 1 пуринов 2 пиримидинов 3 гема 4 холестерина 5 кетоновых тел 30. Продукты распада гема 1 желчные кислоты 2 желчные пигменты 3 протопорфирины 4 уропорфириногены 5 железо 31. Синонимы конъюгированного билирубина 1 свободный 2 связанный 3 прямой 4 непрямой 5 общий 32. Биосинтез РНК на матрице ДНК может контролироваться 1 белковыми факторами транскрипции 2 тиреоидными гормонами 3 стероидными гормонами 4 вазопрессином 5 адреналином 33. Патологический компонент мочи 1 мочевина 2 креатинин 3 креатин 4 мочевая кислота 5 хлорид натрия 34. b-аланин 1 входит в состав белков 2 является конечным продуктом распада уридина 3 является конечным продуктом распада аденозина 4 входит в состав КоА 5 участвует в орнитиновом цикле | 35. Наибольшее количество минорных нуклеотидов включается в 1 тРНК 2 мРНК 3 рРНК 36. Наибольшее количество атомов включается в пуриновое кольцо из молекулы 1 глутамина 2 аспартата 3 глицина 4 аргинина 5 аспарагина 37. Фермент, синтезирующий аминоацил-тРНК, относится к классу 1 трансфераз 2 лиаз 3 лигаз (синтетаз) 4 оксидоредуктаз 5 изомераз 38. В образовании дезоксирибо-нуклеозиддифосфатов из рибо-нуклеозиддифосфатов участвует 1 цистеин 2 ацетил-КоА 3 тиоредоксин 4 метионин 5 серин 39. Конечный продукт распада аденозина у человека 1 b-аланин 2 ксантин 3 инозиновая кислота 4 мочевая кислота 5 мочевина 40. Железо гемоглобина не связывается с 1 кислородом 2 оксидом углерода (II) 3 цианидами 4 диоксидом углерода (IV) 5 гистидином глобина 41. Аминокислоты, которые встречаются в составе белков 1 пролин 2 орнитин 3 гомоцистеин 4 b-аланин 5 лейцин 42. Прямой билирубин образуется в результате 1 действия на гем гемоксидазы 2 потери гемом атома железа 3 связывания билирубина с глюкуроновой кислотой 4 разрыва порфиринового кольца 5 окисления гема 43. Коферментом d-аминолевулинатсинтазы является 1 ФАД 2 НАД+ 3 ПФ 4 тиаминпирофосфат 5 тетрагидробиоптерин 44. Стеркобилиноген синтезируется 1 в печени 2 в почках 3 в кишечнике 4 в крови 5 в поджелудочной железе 45. Появление в моче производных фенола может быть связано с воздействием микрофлоры кишечника на аминокислоту 1 пролин 2 триптофан 3 аргинин 4 тирозин 5 гистидин 46. Для синтеза белка необходимо наличие 1 двадцати различных аминокислот, связанных с тРНК 2 рибосом 3 ГТФ 4 ЦТФ 5 лизосом 47. Углеводы, участвующие в биосинтезе нуклеиновых кислот, образуются в 1 гликолизе 2 глюконеогенезе 3 гликогенолизе 4 цикле Кребса 5 пентозофосфатном пути окисления глюкозы 48. Источником рибозы и дезоксирибозы для синтеза пуриновых и пиримидиновых нуклеотидов служат метаболиты 1 гликолиза 2 пентозофосфатного пути окисления глюкозы 3 цикла трикарбоновых кислот 4 глюконеогенеза 49. Превращение рибонуклеотидов в дезоксирибонуклеотиды осуществляется путем реакции 1 окисления 2 восстановления 3 гидроксилирования 4 дегидратации 5 дегидрирования 50. Конечным продуктом распада пуриновых нуклеозидов у человека является 1 ксантин 2 гипоксантин 3 аллантоин 4 мочевая кислота 5 мочевина 51. Повышение активности щелочной фосфатазы в крови может происходить при заболеваниях 1 мышц 2 печени 3 поджелудочной железы 4 костной ткани 5 предстательной железы 52. Деградация белков в клетках происходит в 1 протеасомах 2 лизосомах 3 пероксисомах 4 ядре 5 рибосомах 53. Процессы обмена белков, жиров и углеводов в организме человека 1 взаимосвязаны 2 объединены в целостный процесс метаболизма 3 не связаны друг с другом 4 протекают непрерывно 54. Субъединицы рибосом характеризуются 1 массой в граммах 2 размерами в сантиметрах 3 скоростью седиментации в центрифужном поле (в единицах Сведберга) 55. Функция аминоацил-тРНК-синтетаз 1 синтез аминокислот 2 синтез тРНК на матрице ДНК 3 активирование аминокислот и их связывание с тРНК 4 образование пептидных связей между аминокислотами 56. Убиквитин ("метка смерти") присоединяется к белкам по аминокислоте 1 лейцину 2 аланину 3 валину 4 лизину 5 глицину 57. Окрашенные соединения 1 аденин 2 билирубин 3 гемоглобин 4 порфобилиноген 5 пепсин 58. Синтез пиримидиновых нуклеотидов происходит в 1 ядре 2 митохондриях 3 рибосомах 4 цитоплазме 5 лизосомах 59. Продуктами ксантиноксидазной реакции могут быть 1 аденин 2 мочевая кислота 3 мочевина 4 пероксид водорода 5 ацетон 60. Кофеин ингибирует 1 аденилатциклазу 2 гуанилатциклазу 3 фосфодиэстеразу 4 протеинкиназу А 5 протеинкиназу С 61. Гиперурекимия наблюдается при 1 подагре 2 гликогенозах 3 фенилпировиноградной олигофрении 4 бери-бери 5 синдроме Леха-Найана 62. Активность a-амилазы в моче можно определить по скорости расщепления 1 сахарозы 2 лактозы 3 крахмала 4 целлюлозы 63. Ферменты, определение активности которых в сыворотке крови используют в диагностических целях 1 амилаза 2 пепсин 3 реннин 4 креатинкиназа 5 ЛДГ 64. Ферменты, используемые в медицине в терапевтических целях 1 пепсин 2 трипсин 3 химотрипсин 4 коллагеназа 5 аспарагиназа 65. Специфическое связывание и транспорт железа осуществляют белки 1 g-глобулины 2 a-глобулины 3 трансферрины 4 церулоплазмин 5 альбумины 66. Билирубин - глюкуронид образуется в 1 клетках РЭС 2 гепатоцитах 3 клетках почек 4 просвете кишечника 5 энтероцитах 67. Метаболит ЦТК, используемый для синтеза гема 1 ацетил-КоА 2 цитрат 3 2-оксоглутарат 4 сукцинил-КоА 5 сукцинат 68. Конъюгированный билирубин связан с 1 глюкуроновой кислотой 2 альбумином 3 глобулином 4 фосфатом 5 глюконовой кислотой |
Правильные ответы
| 1.4 2.4 3.2 4.2 5.4 6.2, 3, 4 7.4 8.1, 2, 3, 4, 5 9.2, 4, 5 10.1, 2, 3, 4 11.1 12.2, 3, 4 13.2 14.3 15.2 16.1, 2, 3 17.1, 2 18.1, 2, 4 19.4 20.1, 2, 3 21.3 22.1, 2, 3 23.4, 5 | 24.2 25.2 26.5 27.2 28.5 29.3 30.2, 5 31.2, 3 32.1, 2, 3 33.3 34.2, 4 35.1 36.3 37.3 38.3 39.4 40.4 41.1, 5 42.3 43.3 44.3 45.4 46.1, 2, 3 | 47.5 48.2 49.2 50.4 51.2, 4 52.1, 2 53.1, 2, 4 54.3 55.3 56.4 57.2, 3 58.4 59.2, 4 60.3 61.1, 5 62.3 63.1, 4, 5 64.1, 2, 3, 4, 5 65.3 66.2 67.4 68.1 |
Раздел 8: Подготовка к экзамену
Основные вопросы, выносимые на обсуждение
Ø Предмет, задачи и основные направления биологической химии. Химические компоненты живых организмов. Молекулярная логика Жизни. Аминокислоты - составные части белковых молекул. Биологически активные пептиды. Структурное и функциональное разнообразие белков.
Ø Физико-химические свойства белков. Методы изучения белков. Доменная структура белков. Сайт-направленный мутагенез. Понятие о шаперонах. Протеомика. Способы классификации белков. Особенности строения белков соединительной ткани.
Ø Сложные белки. Особенности химического строения и биологическая роль отдельных представителей сложных белков.
Ø Нуклеиновые кислоты. Их химическое строение и биологическая роль. Расшифровка генома человека и становление геномики.
Ø Основы катализа: рибозимы и ферменты. Понятие об энергии активации и переходном состоянии химических реакций. Фермент-субстратные комплексы. Зависимость скорости ферментативных реакций от рН, температуры, концентрации субстрата и фермента. Константа Михаэлиса.
Ø Классификация и номенклатура ферментов. Изоферменты. Иммобилизованные ферменты. Определение активности ферментов. Регуляция ферментативной активности. Синтез и деградация ферментов. Ингибиторы ферментов.
Ø Коферменты - производные витаминов. Функциональная роль коферментов. Причины гиповитаминозных состояний.
Ø Водо- и жирорастворимые витамины. Их биологическая роль.
Ø Классификация липидов и их биологические функции. Строение и функции биологических мембран.
Ø Гормоны - координаторы биохимических процессов. Соподчиненность эндокринных органов. Химическое строение гормонов. Гормон-рецепторные взаимодействия. Внутриклеточные посредники передачи гормонального сигнала.
Ø Введение в обмен веществ и энергии. Питание, метаболизм питательных веществ и выведение конечных продуктов. Понятие о метаболизме и основных метаболических путях. Методы изучения метаболитов в норме и при патологии. Незаменимые (эссенциальные) компоненты питания. Индивидуальные особенности и нарушения обмена веществ.
Ø Основы биоэнергетики обменных процессов. АТФ - универсальный донор свободной энергии. Пути образования АТФ: субстратное и окислительное форфорилирование. Биологичес-кое окисление. Перенос электронов и протонов в дыхательной цепи внутренней мембраны митохондрий. Хемиосмотическая теория Митчелла.
Ø Обмен углеводов. Центральная роль глюкозы в углеводном обмене. Возможные пути превращения глюкозо-6-фосфата. Анаэробные превращения гликогена и глюкозы, их регуляция и энергетический выход. Особенности обмена углеводов в мышцах и печени. Цикл Кори.
Ø Глюконеогенез. Аэробный обмен углеводов. Эффект Пастера. Окислительное декарбоксилирование пировиноградной кислоты. Цикл трикарбоновых кислот Кребса и его связь с биологическим окислением. Регуляция аэробного окисления глюкозы и энергетический выход.
Ø Пентозофосфатный путь окисления глюкозы в разных тканях. Последствия недостаточности тиамина в организме. Особенности углеводного обмена в эритроцитах. Глюкозо-6-фосфатдегидрогеназа, НАДФН(Н+), глутатион и лекарственная гемолитическая анемия.
Ø Гормональная регуляция распада и синтеза гликогена. Болезни накопления гликогена. Нарушения обмена углеводов. Сахарный диабет..
Ø Эйкозаноиды: простагландины, простациклины, лейкотриены и тромбоксаны. Биосинтез, метаболизм, биологическое действие. Ингибиторы синтеза простагландинов и тромбоксанов. Понятие о цитокинах и становление молекулярной иммунологии.
