Количественное определение активности щелочной фосфатазы в сыворотке крови с п-нитрофенилфосфатом
Щелочная фосфатаза содержится в тканях и крови, гидролизует эфиры фосфорной кислоты и в норме поступает в кровь из печени, костной ткани, селезенки, почек, тонкого кишечника и плаценты.
Клинико-диагностическое значение
В клинической практике обычно определяют активность щелочной фосфатазы в сыворотке крови. Активность возрастает при тяжелом рахите, заболеваниях печени (механическая желтуха, острые гепатиты, циррозы), различных заболеваниях костной системы и снижается при хроническом гломерулонефрите, квашиоркоре, гипотиреозе и цинге.
Цель работы
Определить активность щелочной фосфатазы в сыворотке крови и сравнить результаты с нормой.
Принцип метода
Щелочная фосфатаза катализирует гидролиз моноэфиров ортофосфорной кислоты. В качестве субстрата используют бесцветный раствор п-нитрофенилфосфата. В результате реакции освобождается п-нитрофенол, окрашенный в щелочной среде в желтый цвет. В качестве буфера используют 1 М раствор диэтаноламина с хлористым магнием (0,5 мМ). Останавливают реакцию 0,5 М раствором NaОН. Скорость образования в результате реакции окрашенного п-нитрофенола пропорциональна активности щелочной фосфатазы. Активность щелочной фосфатазы сильно зависит от субстрата и от буферной системы, в которой проводится анализ. В силу этого недопустимо сравнивать результаты, полученные в различных буферных системах. Соответственно, и нормальные значения активности щелочной фосфатазы при определении в различных буферных системах существенно различаются.
Реакция протекает по уравнению:
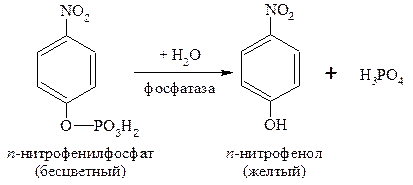
Выполение работы(см. приложение)
| Реагенты | Опыт | Контроль |
| 5 мМ раствор субстрата п-нитрофенилфосфата в буфере, мл | 1,0 | 1,0 |
| Вода дистиллированная, мл | — | 0,05 |
| Выдерживают 5 минут при температуре 37°С в термостате | ||
| Сыворотка крови, мл | 0,05 | — |
| Тщательно перемешивают, замечают время и инкубируют ровно 5 минут при температуре 37°С в термостате | ||
| Раствор NaOH (0,5 М), мл | 1,5 | 1,5 |
| Фотометрируют против Н2О (l = 405 нм, толщина кюветы 0,5 см). D405 | ||
| Dоп - Dк |
Расчеты
Активность щелочной фосфатазы в Е/л (международные единицы активности, мкмоль.мин-1.л-1) рассчитывают по формуле:
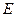 =
= 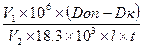
где: V1 – конечный объем пробы, мл
106 – коэффициент пересчета моль в мкмоль
V2 – объем сыворотки, мл
18,3 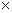 103 –коэффициент молярной экстинкции п-нитрофенола, л.см-1.моль-1
103 –коэффициент молярной экстинкции п-нитрофенола, л.см-1.моль-1
l – толщина кюветы, см
t – время инкубации пробы, мин
Норма: взрослые: при температуре анализа 25°С – 40-170 Е/л
при температуре анализа 37°С – 70-270 Е/л
У детей определение активности щелочной фосфатазы не имеет диагностического значения.
Выводы
Тестовые задания по теме: «Ферменты»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
1. Специфичность действия сложных ферментов определяется коферментом.
2. Активный центр фермента состоит из субстратсвязывающего и каталитического участков.
3. Скорость ферментативной реакции не зависит от концентрации субстрата.
4. Ферменты ускоряют протекание как прямой, так и обратной реакции.
5. Скорость ферментативной реакции всегда увеличивается с увеличением рН среды.
6. Пепсин обладает абсолютной специфичностью действия.
7. Всегда ли происходит образование фермент-субстратного комплекса в процессе ферментативной реакции?
8. Зависит ли скорость ферментативного процесса от количества присутствующего фермента?
9. Влияют ли ионы тяжелых металлов на активность фермента?
10. Можно ли разделить ферменты методом высаливания сульфатом аммония?
11. Известны ли ферменты, обладающие стереоспецифичностью действия?
12. Связано ли действие некоторых лекарственных препаратов с ингибированием отдельных ферментов?
13. Все ферменты состоят из субъединиц.
14. Константа Михаэлиса выражается в единицах концентрации субстрата.
15. Изоферменты катализируют одну и ту же химическую реакцию.
16. Первая цифра в шифре фермента обозначает, к какому классу он относится.
17. В основе классификации ферментов лежит тип катализируемой реакции.
18. Изоферменты имеют различную электрофоретичекую подвижность.
19. Осуществляют ли лигазы расщепление соединений по двойным связям?
20. Существуют ли мультиферментные комплексы?
21. Изменяется ли константа Михаэлиса в присутствии конкурентного ингибитора?
22. Можно ли измерять скорость ферментативной реакции по изменению свойств молекулы кофермента?
23. Всегда ли ингибирование фермента необратимо?
24. Используют ли препараты очищенных ферментов в терапевтических целях?
| Обратимость ферментативной реакции зависит от: 1. температуры 2. ионной силы раствора 3. термодинамического состояния системы 4. концентрации фермента 5. величина рН | К классу оксидоредуктаз не относится фермент: 1. каталаза 2. пероксидаза 3. амилаза 4. аскорбатоксидаза 5. лактатдегидрогеназа |
2) Выбрать один правильный ответ
| Фермент, не относящийся к гидролазам: 1. амилаза 2. трипсин 3. каталаза 4. холинэстераза 5. пепсин | Конкурентные ингибиторы: 1. повышают КМ фермента 2. понижают КМ фермента 3. повышают Vmax 4. понижают Vmax 5. не изменяют КМ и Vmax |
3) Найти соответствие между типом ингибирования ферментативной реакции и его графическим изображением
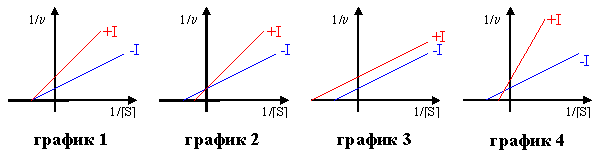
А. конкурентное
Б. неконкурентное
В. смешанное
Г. бесконкурентное
2.3. Коллоквиум II по теме: «Сложные белки, нуклеиновые кислоты и ферменты»
Вопросы, для самостоятельной подготовки
1. Сложные белки и их классификация (примеры).
2. Нуклеопротеины: распространение в организме, биологическая роль. Химический состав нуклеопротеинов. Способы выделения ДНК из клеток.
3. Хромопротеины. Биологическая роль. Структура гемоглобина. Гемоглобинозы и гемоглобинопатии.
4. Структура гемоглобина. Кооперативность действия субъединиц во взаимодействии с кислородом. Аллостерическая регуляция.
5. Фосфопротеины, биологическая роль. Характер связи фосфорной кислоты в фосфопротеинах.
6. Химическое строение и структура нуклеиновых кислот. Первичная, вторичная и третичная структуры ДНК.
7. Рибосомные, информационные и транспортные РНК. Их строение, распространение и биологическая роль.
8. Биологические катализаторы. Рибозимы. Ферменты.
9. Понятие о коферментах. Связь коферментов с витаминами.
10. Понятие об активных центрах ферментов: каталитические и регуляторные центры. Аллостерические эффекторы. Активаторы и ингибиторы ферментов.
11. Общие свойства ферментов: термолабильность, рН-зависимость, специфичность действия.
12. Зависимость между концентрацией субстрата и скоростью ферментативных реакций. Понятие о константе Михаэлиса.
13. Типы ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное ингибирование.
14. Изоферменты и их значение для энзимодиагностики.
15. Классификация ферментов, характеристика каждого класса ферментов (примеры). Способы внутриклеточной регуляции действия ферментов.
16. Примеры использования ферментов в медицине.
Варианты письменной части коллоквиума
| 1. Дать краткое определение и привести три конкретных примера белков класса: 1. металлопротеинов 2. гемопротеинов 3. фосфопротеинов 4. флавопротеинов 2. Соединить в динуклеотид: 1. ЦМФ и ГМФ 2. дЦМФ и ТМФ 3. дАМФ и ТМФ 4. АМФ и ГМФ 3. Как можно разделить: 1. белки и нуклеиновые кислоты? 2. лизин и АТФ? 3. мРНК и тРНК? 4. нуклеотиды и нуклеозиды? | 4. Что такое: 1. константа Михаэлиса? 2. минорные основания? 3. талассемии? 4. аллостерические эффекторы? 5. Чем отличаются: 1. ЛПОНП, ЛПНП и ЛПВП? 2. НbА, HbF, HbS и HbM? 3. синтазы и синтетазы? 4. мРНК, рРНК и тРНК? 6. Объяснить изменение ферментативного действия на примере: 1. изоферментов 2. фосфорилирования/дефосфорилирования 3. регуляции по типу обратной связи 4. конкурентного типа ингибирования |
Варианты заданий на компьютерном тестировании
Инструкция к тесту: выбрать все правильные ответы
1. Фермент амилаза относится к 1. оксидоредуктазам 2. гидролазам 3. лиазам 4. синтетазам 5. изомеразам 2. Смесь ферментов нельзя разделить 1. высаливанием 2. диализом 3. гель-фильтрацией 4. электрофорезом 5. ионообменной хроматографией 3. Превращение альдоз в кетозы катализирует фермент из класса 1. оксидоредуктаз 2. трансфераз 3. гидролаз 4. изомераз 5. лиаз 4. Холинэстераза гидролизует связи 1. сложноэфирные 2. гликозидные 3. пептидные 4. дисульфидные 5. водородные 5. Молекула гема состоит из производных 1. пиррола 2. пурина 3. пиримидина 4. имидазола 5. пиридина 6. Активировать ферменты могут ингибитор 1. аллостерический активатор 2. продукт реакции 3. кофактор 4. изменение рН 7. Один катал – это 1. количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях 2. количество молекул субстрата, превращающихся на 1 молекуле фермента за 1 секунду 3. число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента 4. количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях 5. активность фермента по отношению к наилучшему субстрату 8. Участку ДНК - ГТАЦАГ будет комплементарна последовательность РНК 1. ЦУГУАЦ 2. ЦАУГУЦ 3. ЦТГТАЦ 4. ЦАТГТЦ 5. ГАЦАТГ 9. Нуклеотидом является 1. аденин 2. аденозингидролаза 3. цитидин 4. прион 5. аденозинмонофосфат 10. В молекуле ДНК неверно
| 31. Какие типы связей формируют первичную структуру нуклеиновых кислот? 1. ионные 2. гидрофобные 3. водородные 4. пептидные 5. гликозидные и сложноэфирные 32. Генетический код 1. одинаков у всех организмов 2. одинаков в пределах вида 3. разный у разных организмов 4. строго индивидуален 5. разный у растений и животных 33. Фетальные гемоглобины содержат полипептидные цепи 1. только альфа 2. только бета 3. альфа и бета 4. альфа и гамма 5. только гамма 34. Скорость ферментативной реакции повышается при 1. уменьшении температуры 2. увеличении количества фермента 3. денатурации фермента 4. недостатке кофермента 5. добавлении специфического активатора 35. Конкурентное ингибирование снимается 1. повышением температуры 2. добавлением продукта реакции 3. избытком субстрата 4. ионами тяжелых металлов 36. Ферменты увеличивают скорость реакции 1. повышая энергию активации реакции 2. уменьшая изменение свободной энергии (DG) в ходе реакции 3. понижая энергию активации реакции 4. изменяя константу равновесия реакции 37. Оксидоредуктаза 1. амилаза 2. трипсин 3. каталаза 4. холинэстераза 5. пепсин 38. Каталитической активностью обладает 1. инсулин 2. миоглобин 3. казеин 4. пепсин 5. кератин 39. Гемопротеином не является 1. миоглобин 2. цитохром С 3. каталаза 4. гемоглобин 5. казеин 40. Обратимым может быть ингибирование 1. аллостерическое 2. конкурентное 3. неконкурентное 4. ретроингибирование 5. ингибирование продуктом реакции 41. Удельная активность фермента – это 1. количество фермента, катализирующее образование 1 моль продукта в секунду при стандартных условиях 2. количество молекул субстрата, превращающихся на 1 молекуле фермента за 1 секунду 3. число единиц активности фермента, приходящееся на 1 мг белка в препарате фермента 4. количество фермента, вызывающее превращение 1 мкмоль субстрата в минуту при стандартных условиях 5. активность фермента по отношению к наилучшему субстрату 42. Минорным нуклеотидом природных нуклеиновых кислот не является 1. метилцитидинфосфат 2. оксиметилцитидинфосфат 3. дигидроуридинфосфат 4. псевдоуридинфосфат 5. уриидинфосфат 43. Чем отличаются разные типы РНК? 1. первичной структурой 2. молекулярной массой 3. последовательностью нуклеотидов 4. функциями в клетке 44. Гетероциклические кольца 1. пиримидиновое 2. пиридиновое 3. пуриновое 4. бензольное 5. имидазольное 45. Аллостерический регулятор гемоглобина 1. 1,3-бисфосфоглицериновая кислота 2. 2,3-бисфосфоглицериновая кислота 3. 1-фосфоглицериновая кислота 4. 2-фосфоглицериновая кислота 5. 3-фосфоглицериновая кислота 46. Если концентрация субстрата равна Km, то скорость реакции составляет 1. 0,25 Vmax 2. 0,33 Vmax 3. 0,50 Vmax 4. 0,67 Vmax 5. 0,75 Vmax 47. К гемопротеинам относится 1. пепсин 2. липаза 3. химотрипсин 4. цитохром Р450 5. казеин 48. К гемопротеинам относится 1. пепсин 2. коллаген 3. кератин 4. пероксидаза 5. эластин 49. К фосфопротеинам относится 1. пероксидаза 2. глутатион 3. казеин 4. альбумин 5. протамины 50. Низкомолекулярный пептид 1. пероксидаза 2. глутатион 3. казеин 4. альбумин 5. протамины 51. Низкомолекулярные пептиды 1. пероксидаза 2. брадикинин 3. казеин 4. альбумин 5. ангиотензин 52. Низкомолекулярные пептиды 1. эластин 2. каллидин 3. казеин 4. альбумин 5. аспартам 53. Низкомолекулярные пептиды 1. липаза 2. окситоцин 3. казеин 4. каталаза 5. вазопрессин 54. Регуляция активности ферментов в организме человека осуществляется 1. специфическим гидролизом пептидных связей (прицельным протеолизом) 2. с помощью белков-активаторов или белков-ингибиторов 3. путем отделения регуляторных субъединиц от каталитических 4. аденилированием молекулы фермента 5. фосфорилированием молекулы фермента 55. Ретроингибирование ферментов заключается в 1. связывании отдаленного продукта цепочки превращений с аллостерическим центром первого фермента 2. денатурации фермента 3. связывании с ферментом вторичного посредника 4. связывании с ферментом продукта катализируемой этим ферментом реакции 5. присоединении ингибитора в активном центре фермента 56. Аллостерический ингибитор может 1. быть продуктом реакции, катализируемой данным ферментом 2. вытеснять кофермент из активного центра 3. быть токсическим веществом 4. быть конечным продуктом цепочки последующих превращений 5. конкурентно ингибировать фермент 57. Окрашенной группой хромопротеинов может быть 1. галактозамин 2. пиридоксальфосфат 3. селен 4. гем 5. пальмитиновая кислота 58. N-ацетилнейраминовую кислоту содержат сложные белки 1. хромопротеины 2. гликопротеины 3. липопротеины 4. металлопротеины 5. нуклеопротеины 59. Окрашенной группой хромопротеинов может быть 1. галактоза 2. коэнзим А 3. магний 4. флавинмононуклеотид 5. фосфатидилхолин |
Правильные ответы
| 1.2 2.2 3.4 4.1 5.1 6.2, 4, 5 7.1 8.2 9.5 10.4 11.4 12.3 13.1 14.5 15.3 16.1 17.1, 2 18.4 19.5 20.4 | 21.4 22.1 23.2, 4 24.1 25.2 26.3 27.2 28.2, 3, 4, 5 29.1 30.3 31.5 32.1 33.4 34.2, 5 35.3 36.3 37.3 38.4 39.5 40.1, 2, 3, 4, 5 | 41.3 42.5 43.1, 2, 3, 4 44.1, 2, 3, 5 45.2 46.3 47.4 48.4 49.3 50.2 51.2, 5 52.2, 5 53.2, 5 54.1, 2, 3, 4, 5 55.1 56.4 57.4 58.2 59.4 |
Раздел 3: Витамины, липиды, гормоны
Введение
Витамины - эссенциальные (жизненно важные) факторы питания животных, необходимые для протекания разнообразных химических процессов в организме. Витамины участвуют в обмене веществ как в качестве коферментов – непосредственных участников ферментативных реакций (витамины группы B, витамин РР), так и в виде регуляторов отдельных процессов (витамины С, А, Е, К, D).
Основным источником витаминов являются пищевые продукты растительного и животного происхождения, и лишь некоторые из них (фолиевая кислота, биотин, витамин К) способны синтезироваться микрофлорой кишечника. При недостатке в организме того или иного витамина или нарушении его обмена (всасывания в кишечнике, транспорта кровью, превращения в кофермент) возникают состояния, называемые гиповитаминозами. Определение витаминов в продуктах питания, микробиологических средах, а также стандартизация препаратов витаминов представляют большой практический интерес.
Липиды– группа природных соединений, нерастворимых в воде, но легко растворимых в органических растворителях. Этому условию удовлетворяют разнообразные по строению химические соединения: жирные кислоты и их производные, каротиноиды, терпены, стероиды, сложные липиды, содержащие спирты – глицерин или сфингенин (сфингозин) – и остатки фосфорной кислоты, углеводов и др.
Липиды выполняют разнообразные функции в организме: структурную (участвуют в образовании клеточных мембран), энергетическую (резервную), теплоизолирующую, а также регуляторную (гормоны, вторичные посредники).
Гормоны– биологически активные вещества, синтезируемые эндокринными железами и клетками диффузно-эндокринной системы. Поступая в кровь, данные соединения координируют все виды обмена в организме. Уникальность гормональной регуляции обусловлена соподчинённостью работы желёз внутренней секреции, ауторегуляцией выработки гормонов и агонизмом-антагонизмом их действия относительно друг друга.
В данном разделе предлагается провести количественное определение витаминов С и Р в продуктах питания, познакомиться со спектрофотометрическим способом определения чистоты коммерческого препарата кофермента НАДН(Н+), а также продемонстрировать регулирующее влияние гормонов на содержание глюкозы в крови in vivo.
