Химические свойства оснований. 1. Основания взаимодействуют с кислотами, образуя соль и воду:
1. Основания взаимодействуют с кислотами, образуя соль и воду:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
2. С кислотными оксидами, образуя соль и воду:
Ca(OH)2 + CO2 = CaCO3 + H2O
3. Щелочи реагируют с амфотерными оксидами и гидроксидами, образуя соль и воду:
2NaOH + Cr2O3 = 2NaCrO2 + H2O
KOH + Cr(OH)3 = KCrO2 + 2H2O
4. Щелочи взаимодействуют с растворимыми солями, образуя, либо слабое основание, либо осадок, либо газ:
2NaOH + NiCl2 = Ni(OH)2¯ + 2NaCl
слабое
основание
2KOH + (NH4)2SO4 = 2NH3 + 2H2O + K2SO4
газ
Ba(OH)2 + Na2CO3 = BaCO3¯ + 2NaOH
Осадок
5. Щелочи реагируют с некоторыми металлами, которым соответствуют амфотерные оксиды:
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
6. Действие щелочи на индикатор:
OH- + фенолфталеин ® малиновый цвет
OH- + лакмус ® синий цвет
7. Разложение некоторых оснований при нагревании:
t
Сu(OH)2 ® CuO + H2O
Амфотерные гидроксиды – химические соединения, проявляющие свойства и оснований, и кислот. Амфотерные гидроксиды соответствуют амфотерным оксидам (см. п.3.1).
Амфотерные гидроксиды записывают, как правило, в форме основания, но их можно представить и в виде кислоты:
Zn(OH)2 Û H2ZnO2
основание к-та
Химические свойства амфотерных гидроксидов
1. Амфотерные гидроксиды взаимодействуют с кислотами и кислотными оксидами:
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + SO3 = BeSO4 + H2O
2. Взаимодействуют со щелочами и основными оксидами щелочных и щелочноземельных металлов:
Al(OH)3 + NaOH = NaAlO2 + 2H2O;
H3AlO3 кислота метаалюминат натрия
(H3AlO3 ® HAlO2 + H2O)
2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Все амфотерные гидроксиды являются слабыми электролитами
Соли
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. Соли представляют собой продукты полного или частичного замещения ионов водорода ионами металла (или аммония) у кислот. Типы солей: средние (нормальные), кислые и основные.
Средние соли – это продукты полного замещения катионов водорода у кислот ионами металла (или аммония) :Na2CO3, NiSO4, NH4Cl и т.д.
Химические свойства средних солей
1. Соли взаимодействуют с кислотами, щелочами и другими солями, образуя, либо слабый электролит, либо осадок; либо газ:
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
Na2SO4 + Ba(OH)2 = BaSO4¯ + 2NaOH
CaCl2 + 2AgNO3 = 2AgCl¯ + Ca(NO3)2
2CH3COONa + H2SO4 = Na2SO4 + 2CH3COOH
слабая
кислота
NiSO4 + 2KOH = Ni(OH)2¯ + K2SO4
слабое
основание
NH4NO3 + NaOH = NH3 + H2O + NaNO3
газ
2. Соли взаимодействуют с более активными металлами. Более активный металл вытесняет менее активный из раствора соли (прил. 3).
Zn + CuSO4 = ZnSO4 + Cu
Кислые соли – это продукты неполного замещения катионов водорода у кислот ионами металла (или аммония): NaHCO3, NaH2PO4, Na2HPO4 и т.д. Кислые соли могут быть образованы только многоосновными кислотами. Практически все кислые соли хорошо растворимы в воде.
Получение кислых солей и перевод их в средние
1. Кислые соли получают при взаимодействии избытка кислоты или кислотного оксида с основанием:
H2CO3 + NaOH = NaHCO3 + H2O
CO2 + NaOH = NaHCO3
2. При взаимодействии избытка кислоты с основным оксидом:
2H2CO3 + CaO = Ca(HCO3)2 + H2O
3. Кислые соли получают из средних солей, добавляя кислоту:
· одноименную
Na2SO3 + H2SO3 = 2NaHSO3 ;
· другую
Na2SO3 + HCl = NaHSO3 + NaCl
4. Кислые соли переводят в средние, используя щелочь:
NaHCO3 + NaOH = Na2CO3 + H2O
Основные соли – это продукты неполного замещения гидроксогрупп (ОН-) основания кислотным остатком: MgOHCl, AlOHSO4 и т.д. Основные соли могут быть образованы только слабыми основаниями многовалентных металлов. Эти соли, как правило, труднорастворимы.
Получение основных солей и перевод их в средние
1. Основные соли получают при взаимодействии избытка основания с кислотой или кислотным оксидом:
Mg(OH)2 + HCl = MgOHCl¯ + H2O
гидроксо-
хлорид магния
Fe(OH)3 + SO3 = FeOHSO4¯ + H2O
гидроксо-
сульфат железа (III)
2. Основные соли образуются из средней соли при добавлении недостатка щелочи:
Fe2(SO4)3 + 2NaOH = 2FeOHSO4 + Na2SO4
3. Основные соли переводят в средние, добавляя кислоту (лучше ту, которая соответствует соли):
MgOHCl + HCl = MgCl2 + H2O
2MgOHCl + H2SO4 = MgCl2 +MgSO4 + 2H2O
ЭЛЕКТРОЛИТЫ
Электролиты – это вещества, распадающиеся на ионы в растворе под влиянием полярных молекул растворителя (Н2О). По способности к диссоциации (распаду на ионы) электролиты условно делят на сильные и слабые. Сильные электролиты диссоциируют практически полностью (в разбавленных растворах), а слабые распадаются на ионы лишь частично.
К сильным электролитам относятся:
· сильные кислоты (см. с. 20);
· сильные основания – щелочи (см. с. 22);
· практически все растворимые соли.
К слабым электролитам относятся:
· слабые кислоты (см. с. 20);
· основания – не щелочи;
· Н2О.
Одной из основных характеристик слабого электролита является константа диссоциации – К. Например, для одноосновной кислоты,
HA Û H+ + A-,
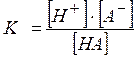 ,
,
где, [H+] – равновесная концентрация ионов H+;
[A-] – равновесная концентрация анионов кислоты А-;
[HA] – равновесная концентрация молекул кислоты,
Или для слабого основания,
MOH Û M+ + OH-,
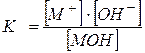 ,
,
где, [M+] – равновесная концентрация катионов M+;
[OH-] – равновесная концентрация гидроксид ионов ОН-;
[MOH] – равновесная концентрация молекул слабого основания.
Константы диссоциации некоторых слабых электролитов (при t = 25°С)
| Вещество | К | Вещество | К |
| HCOOH | K = 1,8×10-4 | H3PO4 | K1 = 7,5×10-3 |
| CH3COOH | K = 1,8×10-5 | K2 = 6,3×10-8 | |
| HCN | K = 7,9×10-10 | K3 = 1,3×10-12 | |
| H2CO3 | K1 = 4,4×10-7 | HClO | K = 2,9×10-8 |
| K2 = 4,8×10-11 | H3BO3 | K1 = 5,8×10-10 | |
| HF | K = 6,6×10-4 | K2 = 1,8×10-13 | |
| HNO2 | K = 4,0×10-4 | K3 = 1,6×10-14 | |
| H2SO3 | K1 = 1,7×10-2 | H2O | K = 1,8×10-16 |
| K2 = 6,3×10-8 | NH3× H2O | K = 1,8×10-5 | |
| H2S | K1 = 1,1×10-7 | Al(OH)3 | K3 = 1,4×10-9 |
| K2 = 1,0×10-14 | Zn(OH)2 | K1 = 4,4×10-5 | |
| H2SiO3 | K1 = 1,3×10-10 | K2 = 1,5×10-9 | |
| K2 = 1,6×10-12 | Cd(OH)2 | K2 = 5,0×10-3 | |
| Fe(OH)2 | K2 = 1,3×10-4 | Cr(OH)3 | K3 = 1,0×10-10 |
| Fe(OH)3 | K2 = 1,8×10-11 | Ag(OH) | K = 1,1×10-4 |
| K3 = 1,3×10-12 | Pb(OH)2 | K1 = 9,6×10-4 | |
| Cu(OH)2 | K2 = 3,4×10-7 | K2 = 3,0×10-8 | |
| Ni(OH)2 | K2 = 2,5×10-5 |
