Общие приемы хроматографического разделения на колонках
Простейшая система для хроматографического разделения на колонках изображено на рис. 12. Колонки (рис. 13, 1) представляют собой полые стеклянные трубки, размер которых зависит от целей работы и способа разделения. В основание колонки впаивают пористую стеклянную пластинку или перфорированный диск (2). Необходимо следить за тем, чтобы «мертвое» пространство под диском, между ним и основанием колонки, а также внутренний диаметр шлангов, по которым выходящий из колонки элюат поступает в коллектор фракций (рис. 12, 5), были минимальными. В противном случае происходит смешивание уже разделенных фракций.
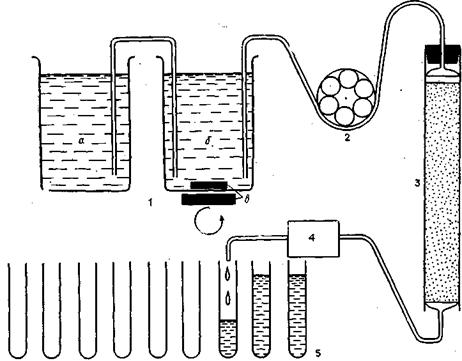
Рис. 12. Схема устройства для колоночной хроматографии.
1 — прибор для создания линейного градиента (а — сосуд с раствором высокой концентрации; б — сосуд-смеситель; в — магнитная мешалка); 2 — перистальтический насос; 3 — колонка; 4 — УФ-детектор; 5 — коллектор фракций
Коммерческие колонки (рис. 13, Б) бывают снабжены специальными приспособлениями — концевыми адаптерами переменной длины (10), которые позволяют регулировать длину колонки и сводят к минимуму перемешивание элюируемых фракций.
Заполнение колонкиимеет первостепенное значение для успешного разделения исследуемых веществ. Колонку укрепляют строго вертикально, закрывают нижний кран (зажим) (рис. 13, 4) и наливают в нее примерно на 1/3 ее объема дистиллированной воды. Энергичными движениями стеклянного поршня освобождают пространство под диском от пузырьков воздуха. На диск с помощью поршня помещают кружок фильтровальной бумаги, по размерам точно соответствующий внутреннему диаметру колонки. Поршень осторожно вынимают, следя за тем, чтобы в колонку не попали пузырьки воздуха. Через воронку или по палочке наливают в колонку густую, тщательно взмученную взвесь используемого сорбента так, чтобы жидкость стекала по стенке колонки и не увлекала в свою толщу пузырьков воздуха. Суспензии дают осесть, через несколько минут открывают кран и продолжают наполнение колонки, постепенно подливая следующие порции взвеси. Во избежание слишком сильного уплотнения сорбента заполнение колонки производят при небольшом давлении (особенно важно следить за этим при работе с гелем сефадекса). Давление определяет величина h (рис. 13, А) — разница между уровнем жидкости над сорбентом в колонке (или присоединенном к ней верхнем резервуаре) и положением конца шланга, по которому элюат вытекает из колонки. Необходимо следить за тем, чтобы наполнение колонки было равномерным.
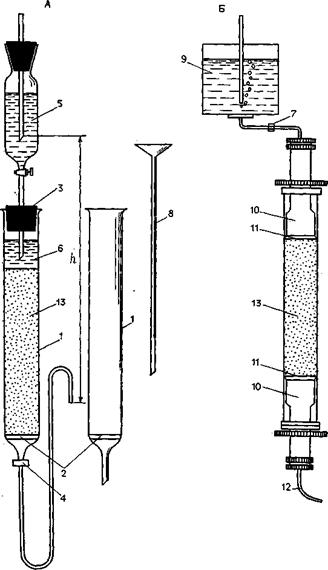
Рис. 13. Хроматографические колонки упрощенного (А) и усложненного (Б) варианта.
1 — стеклянная колонка; 2 — перфорированный диск; 3 — пробка со стеклянной трубкой; 4, 7 —кран-зажим; 5, 9 —верхний резервуар; 6 —буферный раствор над гелем; 8 — стеклянный поршень; 10 — адаптеры; 11— сетка из нейлона; 12 — капиллярный шланг, соединенный с регистрирующим устройством и (или) коллектором фракций
Заполнив колонку до нужной высоты, закрывают нижний кран (зажим) и дают суспензии осесть, не допуская «высыхания» наполнителя в колонке (для этого над верхним слоем сорбента всегда должен находиться слой растворителя). Следят также за тем, чтобы верхний слой наполнителя имел гладкую горизонтальную поверхность. Для уменьшения взмучивания верхнего слоя при внесении в колонку образца над ним иногда помещают кружок фильтровальной бумаги. Колонку закрывают пробкой с отводом или со стеклянной трубкой и присоединяют к резервуару (рис. 13, Б), содержащему элюирующий раствор. Для поддержания постоянного давления и сохранения постоянной скорости тока жидкости через колонку используют склянку Мариотта или насосы различных конструкций. Наибольшее распространение получили перистальтические насосы, важным преимуществом которых является отсутствие контакта подаваемого раствора с любыми материалами за исключением силикона и полиэтилена, из которых изготовлены шланги.
Внесение образца в колонку можно производить несколькими способами. Самый простой из них заключается в следующем: жидкость с поверхности наполнителя осторожно удаляют, оставляя слой в 1-2 мм; при помощи пипетки осторожно вносят образец и, открыв нижний кран, дают ему впитаться; остатки образца над сорбентом смывают небольшой порцией элюента. После того, как он впитается поверхностью наполнителя, добавляют новые порции элюирующего раствора, создавая слой в 5-10 см. Другой способ внесения образца, при котором избыток жидкости не удаляют из колонки, заключается в увеличении плотности раствора образца путем добавления сахарозы до концентрации 0,5 М. Раствор образца при этом спускают под слой растворителя и он быстро впитывается в верхний слой наполнителя.
После нанесения образца колонку соединяют с верхним резервуаром, устанавливают необходимую скорость протекания элюирующего раствора путем изменения рабочего давления и начинают сбор фракций с помощью коллектора. Собирать фракции элюата необходимо с момента нанесения образца на колонку. Фракции можно собирать в пробирку по объему (с помощью сифонов), по определенному количеству капель или через определенные промежутки времени.
При проведении гель-хроматографии элюирование разделяемых веществ с колонок может быть только изократическим, то есть сила элюента постоянна в течение всего процесса. Во всех остальных случаях элюирование, как правило, проводят, повышая силу элюента. Например, при ионообменной хроматографии это достигается изменением рН, ионной силы или обоих показателей одновременно. При этом градиент рН и ионной силы может быть ступенчатым или непрерывным (плавным). При создании ступенчатого градиента пользуются серией буферных растворов, пропускаемых через колонку последовательно один за другим. При этом виде элюции каждый из буферных растворов пропускают через колонку до тех пор, пока концентрация белка в вытекающем из колонки элюате, пройдя через максимум, не снизится почти до исходных фоновых значений.
При непрерывном градиенте элюции (используемый в литературе термин «градиентная элюция» относят лишь к такому виду градиента) изменение ионной силы и (или) рН элюирующего раствора происходит постепенно, по линейной или нелинейной зависимости от объема протекающей жидкости. Линейное изменение ионной силы или рН элюирующего раствора происходит тогда, когда эти параметры изменяются пропорционально объему протекающей жидкости. Получить линейный градиент можно с помощью прибора, состоящего из двух соединенных между собой одинаковых сосудов, установленных на одном уровне (рис. 14, А). В одном сосуде (1) находится буферный раствор со значением ионной силы (или рН), которое должно быть достигнуто к концу опыта, в другом смесителе (2), из которого раствор поступает непосредственно в колонку, вначале находится равный объем исходного буферного раствора.
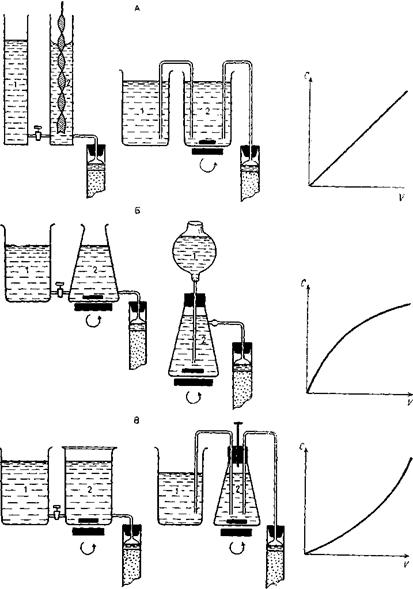
Рис. 14. Приборы для создания градиента концентрации: А —линейного, Б — выпуклого, В — вогнутого (объяснения в тексте)
Часто применяют «выпуклый» или «вогнутый» градиенты, при которых ионная сила раствора увеличивается или уменьшается соответственно по экспоненциальной зависимости. Форму этих градиентов легко получить с помощью простого устройства, изображенного на рис. 14, Б, В.
Лабораторная работа №4.1
Разделение белков методом гель-хроматографии
При гель-хроматографии никакого специального сродства разделяемых веществ к подвижной и неподвижной фазам нет. Неподвижная фаза представляет собой жидкость, расположенную внутри пористых гранул. Подвижная фаза - такую же, как и подвижная фаза, жидкость, протекающую между гранулами. В подавляющем большинстве случаев в качестве такой жидкости используют водно-солевые растворы. Материал гранул в этом случае должен быть гидрофилен.
Фактором, определяющим возможность фракционирования, является различие степени доступности объема неподвижной фазы для молекул различных компонентов смеси вследствие их объема (рис.15). Очень крупные молекулы, вовсе не проникающие в гранулы, будут выходить вместе с передним фронтом подвижной фазы (так называемым фронтом элюции). Самые мелкие молекулы (например, неорганические ионы) часть времени будут проводить внутри гранул (то есть в неподвижной фазе) и выдут все одновременно и заведомо позднее крупных. Частицы промежуточного размера будут двигаться с промежуточной скоростью, так как для них доступна только часть объема гранул.
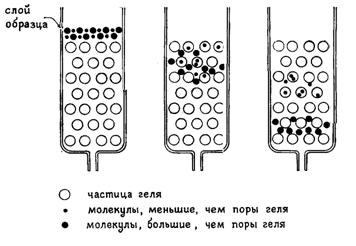
Рис. 15. Разделение двух типов молекул при прохождении через колонку, содержащую частицы пористого геля. Молекулы, размеры которых больше размера пор, двигаются быстрее тех молекул, размеры которых меньше.
При гель-хроматографии разделение частиц, в первую очередь, происходит в соответствии с их объемом. С учетом возможных различий плотности частиц и их формы можно говорить о разделении в соответствии с массой частиц.
На этом принципе основаны методы фракционирования белков и других полимеров, их обессоливание, определение молекулярной массы, замена одних буферных растворов другими и др.
Для большого числа глобулярных белков имеется линейная зависимость между логарифмом молекулярной массы и объемом элюирования с колонки, заполненной гелем с определенной величиной пор. Поэтому для определения молекулярной массы глобулярного белка достаточно определить объем его элюции с предварительно откалиброванной колонки. Калибровку колонки проводят, пропуская через нее белки с известной молекулярной массой и определяя объемы элюции для каждого из них. Объем элюции (Ve)—это объем элюата, собранного с момента внесения вещества на колонку до момента его выхода из колонки, включая фракцию с максимальным его содержанием. Величиной, более стабильной, чем объем элюции (Ve), не зависящей от уровня геля в колонке, является величина Kav:
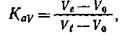
где Ve — объем элюции для данного вещества, V0 — свободный объем колонки, Vt — общий объем колонки.
Наиболее широкое распространение среди носителей для гель-хроматографии белков получили сорбенты, приготовленные на основе декстрана (сефадексы, молселекты), полиакриламида (биогели Р, акрилексы) и агарозы (сефарозы, биогели А), а также комбинированные гели гели (например сефакрилы на основе декстрана и полиакриламида).
Студентам предлагается провести разделение смеси белков на колонке с сефадексом.
Сефадексы — продукты взаимодействия полисахарида декстрана с эпихлоргидрином. Они устойчивы к органическим растворителям, растворам щелочей и разбавленных кислот (до 0,1 н.). Рабочий диапазон рН составляет 2—10. Гели декстрана подвержены действию сильных окислителей, вызывающих образование карбоксильных групп.
Номера в маркировке сефадексов характеризуют их пористость. Выбор определенной марки сефадекса определяется молекулярной массой исследуемого белка (чем больше соответствие размеров молекул и величины пор, тем выше селективность), а степень зернения — поставленной задачей. Для обессоливания растворов белков и их концентрирования обычно используют сефадексы G-25и G-50 (грубый или средний). При разделении же смеси белков пользуются сефадексами тонкого или сверхтонкого зернения. Чем мельче частицы геля, тем эффективнее происходит разделение, но тем меньше скорость протекания раствора через колонку.
При работе сефадексам дают предварительно набухнуть в избытке растворителя. Время и температура набухания указаны в соответствующих таблицах.
Материалы и оборудование: комплект оборудования для хроматографии на колонках; спектрофотометр; белки с определенной молекулярной массой (кДа): яичный альбумин (45,0), гемоглобин (68,0), бычий сывороточный альбумин (68,0), рибонуклеаза из поджелудочной железы (12,7), цитохром с (13,0); голубой декстран (м.м. — 2000 кДа); фосфатный буферный раствор, содержащий 0,05 М КС1, рН 6,5; сефадекс G-100 или сефакрил S-200;.40%-й раствор сахарозы, насыщенный раствор рибофлавина.
Ход работы
Разделение белков на колонках с сефадексом. Сухой сефадекс суспендировать в 200-кратном объеме дистиллированнойводы и оставить стоять на 48 ч при комнатной температуре для полного набухания. Набухание можно ускорить, проводя его на кипящей водяной бане в течение 5 ч.
Колонку (размером 1,5∙50 см)[2] подготавить так, как описано в разделе «Общие приемы хроматографического разделения на колонках». В нее внести относительно густую суспензию полностью набухшего геля. Для предотвращения образования пузырьков воздуха в слое геля в колонке суспензию сефадекса перед заполнением колонки можно деаэрировать с помощью водоструйного насоса в колбе Бунзена или вносить его в колонку при температуре, значительно превышающей комнатную (50-600С). Сефадексу в колонке дать отстояться, затем с целью уравновешивания и достижения постоянной высоты столба геля колонку промыть 3-5 объемами буферного раствора. Гидростатическое давление для сефадекса G-100 не должно превышать 50 см: h=20-50 см (давление при разделении образца и при заполнении колонки должно быть одинаковым). Для проверки равномерности заполнения через колонку можно пропустить раствор окрашенного белка, например цитохрома с или голубого декстрана. При этом окрашенная зона должна быть компактной и двигаться по колонке параллельно ее основанию.
Исследуемую белковую смесь растворить в буферном растворе в объеме 1 мл [3] (по 2-4 мг каждого белка) и внести в колонку. Нанесение пробы на колонку проводить, как описано в разделе «Общие приемы хроматографического разделения на колонках», увеличив плотность раствора добавлением сахарозы до 0,5 М.
Перед использованием колонки определить ее свободный объем (V0). Для этого через колонку пропустить 1 мл (1 мг/мл) раствора голубого декстрана в 0,5 М растворе сахарозы. В качестве растворителя как для голубого декстрана, так и для исследуемых белков применять тот же буферный раствор, которым уравновешена колонка. Им же элюировать белки с колонки после нанесения анализируемой смеси. Следует отметить, что поскольку положительно заряженные частицы могут частично взаимодействовать с сефадексом (за счет имеющихся карбоксильных групп), для элюции обычно используют растворы с ионной силой выше 0,02. Если исследуемые белки после гель-хроматографии надлежит лиофилизировать, для элюции используют летучие буферные растворы (аммоний бикарбонатный, ацетатный, формиатный и др.).
Вытекающий из колонки буферный раствор собирать в пробирки порциями по 1-3 мл. Регистрацию объема элюата, прошедшего через колонку, начинают с момента нанесения образца на колонку. Содержание белка во фракциях определять спектрофотометрически по оптической плотности при длине волны 280 нм. Оптическую плотность растворов, содержащих рибонуклеазу, определять при 230 нм, голубой декстран — при 650 нм, цитохром с — при 412 нм. После окончания анализа колонку промыть несколькими объемами буферного раствора. Построить профиль элюирования отдельных белковых фракций. Для этого построить график, на горизонтальной оси которого отложить номера пробирок (фракций) или объем прошедшей через колонку жидкости, а на вертикальной оси — величины оптической плотности фракций.
Регенерация и хранение сефадекса. Многократное использование колонки с сефадексом приводит к замедлению протекания жидкости через нее. В этом случае гель извлекают из колонки, отмучивают его от мелких частиц и колонку набивают заново.
Сефадексы можно хранить в виде суспензии или в сухом виде. Суспензию сефадекса следует хранить в холодильнике в присутствии антисептиков: 0,02%-го азида натрия, мертиолата или хлороформа. Для переведения геля в сухое состояние сефадекс сначала промывают водой для удаления солей, а затем выдерживают несколько минут в 2-кратном объеме 50%-го этанола. После фильтрования на воронке Бухнера сефадекс выдерживают в 2-кратным объеме 96%-го этанола. Обработку последним повторяют несколько раз. Осадок высушивают в термостате при температуре 60-800С.
Лабораторная работа №4.2
Разделение белков методом ионообменной хроматографии
В основе разделения соединений методом ионообменной хроматографии лежат реакции ионного обмена между анализируемыми соединениями и сорбентами-ионитами, имеющими в своем составе ионизируемые группировки.
На всей поверхности гранул или волокон расположены ионогенные группы. Их заряд, также как и заряд большинства биологических молекул завит от рН элюента. Таким образом, сродство разделяемых веществ будет определяться количеством и характером имеющихся на них ионогенных групп, рН и ионной силой раствора.
Если модифицирующие группы несут отрицательный заряд, то они будут связывать положительно заряженные молекулы, такие обменники называют катионообменниками или катионитами. Соответственно, матрицы, модифицированные привязкой положительно заряженных функциональных групп, называют анионообменниками (анионитами). Наиболее часто используемые в биохимии модифицирующие группы для ионообменной хроматографии приведены в таблице 7.
Таблица 7 - Наиболее часто используемые модифицирующие группы для ионообменной хроматографии биополимеров
| Название модифицирующей группы | Формула модифицирующей группы | Обозначение ионообменника |
| Сильные катиониты (катионообменники) - заряжены отрицательно | ||
| Сульфо- | -SO3- | S- |
| Cульфометил- | -СН2SO3- | SМ- |
| Сульфоэтил- | -С2Н4SO3- | SЕ- |
| Сульфопропионил- | -С3Н6SO3- | SР- |
| Фосфо- | -РО3Н- | Р |
| Слабые катиониты (катионообменники) - заряжены отрицательно | ||
| Карбокси- | -СОО- | С- |
| Карбоксиметил- | - СН3СОО- | СМ- |
| Сильные аниониты (анионообменники) - заряжены положительно | ||
| Триметиламинометил- | -СН2N(CH3)3+ | TAM- |
| Триэтиламиноэтил- | -С2Н4N(C2H5)3+ | TEAE- |
| Триэтил-2-оксипропиламиноэтил- | -С2Н4N(C2H5)2СH2CH(OH)CH3+ | QAЕ- |
| Слабые аниониты (анионообменники) - заряжены положительно | ||
| Аминоэтил- | -С2Н4NН3+ | AE- |
| Диэтиламиноэтил- | -С2Н4NН(C2H5)2+ | DEAE- |
| Полиэтиленимин | -(С2Н4NH2)nС2H4NH3+ | PЕI- |
| Парааминобензил | -СН2-C6H4-NH3+ | PAB- |
Название ионообменника образуется добавлением одной из приставок, приведенных в третьем столбце таблицы к названию модифицируемой матрицы (DEAE-целлюлоза, СМ-агароза и т.д.).
В зависимости от влияния рН на число заряженных групп ионообменники разделяют на сильные и слабые. Различие между этими типами сорбентов становится очевидным из рис. 16, на котором приведены кривые титрования сильных (слева) и слабых (справа) ионообменников.
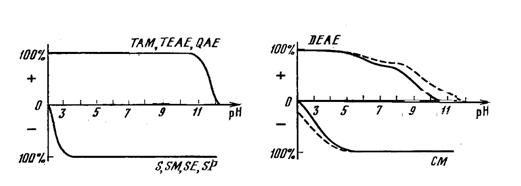
Рис. 16. Кривые титрования сильных (левый рисунок) и слабых (правый рисунок) ионообменников. По оси ординат отложена доля заряженных модифицирующих групп.
Сильные аниониты (TAM, TEAE, QAE) и катиониты (S, SM, SE, SPВ) находятся полностью в заряженном состоянии практически во всем диапазоне рН и теряют заряд соответственно лишь при рН ниже 3 или выше 11. Число же заряженных групп слабых ионообменников DEAE и CM возрастает постепенно в достаточно широком интервале рН. Как следствие, слабые ионнообменники обеспечивают менее прочную связь с разделяемыми биомолекулами. При разделении белков и других биополимеров достаточно сложной проблемой является возникновение многоточечного связывания, которое может приводить к необратимой сорбции белков на неподвижной фазе. По этой причине значительно более широкое распространение в биохимии получили слабые ионообменники, в первую очередь - DEAE и CM.
Для слабого ионообменника характерно не только сужение рабочего диапазона рН, но и уменьшение прочности сорбции вещества в пределах этого диапазона (в области изменения суммарного заряда). При тех значениях рН, когда ионизация слабого ионообменника не достигает 100%, имеет место динамическое равновесие заряженных и незаряженных состояний, в котором участвуют все ионогенные группы обменника. Это означает, что любая из них в какой-то момент времени оказывается нейтрализованной и перестает удерживать около себя ион вещества. В результате этого динамического процесса даже в условиях, когда число заряженных групп ионообменника (например, в пределах одной его гранулы) больше числа ионов вещества, часть последних в любой момент времени может оказаться свободной от связи с обменником и покинуть гранулу.
С изменением рН раствора, например при титровании ионообменника, происходит либо присоединение, либо диссоциация протонов от ионогенных групп с соответствующим изменением (появлением или исчезновением) их зарядов. Контрионы в растворе взаимодействуют с ионами обменника на расстоянии, связываются с ними кулоновскими силами взаимного притяжения и лишь экранируют их заряд. С позиций связывания ионов и молекул вещества, на первый взгляд, нет особой разницы между исчезновением электрического заряда, т. е. истинной нейтрализацией ионогенной группы, и ее экранированием. Однако такая разница есть - она касается прочности взаимодействий. Электростатические (кулоновские) силы взаимодействия между ионами несравненно слабее ковалентных связей. Для слабых ионообменников акты присоединения и диссоциации протонов от ионогенных групп чередуются по времени, однако эти события происходят очень редко по сравнению с непрерывной «сутолокой» приближения, удаления и смены контрионов вблизи неподвижного иона обменника. То же самое происходит вблизи практически неизменных ионов сильного ионообменника. «Танец» контрионов в окрестности неподвижного иона определяется суперпозицией двух факторов: их броуновского движения под ударами молекул растворителя и постоянно действующей силы кулоновского притяжения. Эти факторы, очевидно, должны зависеть от физической природы контрионов: их размеров, формы и плотности электронных оболочек и др. Действительно, контрионы можно расположить во вполне определенные ряды активности, ориентируясь по способности одних контрионов оттеснять другие (при равенстве концентраций) из связи с ионами обменника. Приведем эти ряды в порядке убывания такой активности для анионов и катионов, выделив в последнем случае двухвалентные катионы в отдельнуюгруппу.
Анионы: I- > N03- > Вг- > СN- > HS03- > С1-> HCO3- > НСОО- > СН3СОО- > ОН- > F-.
Катионы: Ag+ > Cs+ > Rb+> K+≈NH4+> H+> Li+; Ba2+> Ca2+> Mn2+> Mg2+
Знание этих рядов весьма полезно при выборе систем хроматогра-фической элюции.
В сухом виде продажные ионообменники поставляются вместе с контрионами. Называя их, принято говорить о «форме» ионообменника. Например, указание на то, что данный катионообменник находится в «Н+-форме» или «Nа+-форме», означает, что его кислые ионогенные группы (остатки кислот) нейтрализованы соответственно ионами Н+ или Na+. В одной из этих двух форм катионообменники обычно и поставляются фирмами-производителями. Анионообменники чаще всего производятся в ОН-- или С1--форме.
Помимо рН подвижной фазы сродство разделяемых молекул к неподвижной фазе будет определять ионная сила элюента. То есть, десорбцию вещества с ионообменника практически с одинаковым успехом можно осуществить изменением рН элюента (то есть снижением заряда белка или сорбента) или повышением содержания в подвижной фазе нейтрального электролита (чаще всего NaCl).
Белки могут быть разделены как на катионитах, так и на анионитах. Выбор типа ионита определяется изоэлектрическими точками хроматографируемого материала и устойчивостью белка в определенной зоне значение рН.
Эффективная сорбция белков происходит при значениях рН, отстоящих не менее чем на единицу от рI. В области рН< рI—1 белки можно хроматографировать на катионитах, а в области рН> рI+1 — на анионитах. Изменение рН в направлении к изоэлектрической точке способствует десорбции белков. При работе с белками используют буферные растворы с низкой ионной силой, но высокой буферной емкостью. Для этого пользуются буферными растворами, рК которых отстоит от величины рН, используемой в эксперименте, не более чем на 0,3-0,5 единиц рН. Хроматографию на анионитах ведут в таких системах, где диссоциируемым компонентом является катион (буферы: трис, пиридин, имидазол и др.), а для катионитов диссоциируемым компонентом является анион (ацетатный, фосфатный, бикарбонатный буфер и др.).
При ионообменной хроматографии смесь белков сорбируется в верхней части колонки и затем вытесняется веществами, уменьшающими их сорбцию на ионите. Понижение сорбции осуществляют повышением ионной силы раствора и (или) изменением его рН. Изменение рН и ионной силы элюирующего буферного раствора можно проводить путем создания ступенчатой или градиентной элюции.
Подготовка ионообменников к работе. Использованию ионитов для хроматографического разделения белков предшествует их предварительная обработка. Иониты промышленного изготовления после набухания, во-первых, фракционируют по размеру частиц (однородность частиц сорбентов по размеру — одно из важных условий успешной хроматографии) и, во-вторых, подвергают «циклизации» — переводу их из одной формы в другую. Катиониты переводят из Nа+-формы в Н+-форму или наоборот, а аниониты — из С1--формы в ОН--форму или наоборот. В процессе такой обработки стабилизируется структура ионита и функциональные группы становятся более доступными. Одновременно ионит освобождается от примесей.
Навеску порошка сорбента суспендируют в 50-кратном и более объеме дистиллированной воды, перемешивают и оставляют набухать на ночь. Слой жидкости над ионообменником декантируют, снова заливают дистиллированной водой, перемешивают и через 2-2,5 ч верхний слой жидкости декантируют вместе с неосевшими мелкими частицами. К оставшемуся осадку приливают 50-кратный объем 0,5 н. NaOH, тщательно перемешивают и через час ионит фильтруют через воронку Бухнера [4]. Осадок на воронке промывают водой до рН 7,0. Затем ионит перемешивают в 50-кратном объеме 0,5 н. НС1 и через 30-60 мин (время обработки ионита кислотой не должно быть большим) отмывают дистиллированной водой примерно до рН 5,0. На следующем этапе в случае анионитов, например ДЭАЭ-целлюлозы, сорбент повторной обработкой щелочью переводят в ОН--форму. Для этого его суспендируют в 50-кратном объеме 0,5 н. NaOH, перемешивают и через час отмывают дистиллированной водой до рН воды. В случае катионитов, например КМ-целлюлозы, сорбент повторной обработкой кислотой переводят в Н+-форму. Для этого его суспендируют в 50-кратном избытке 0,5 М раствора НС1 в течение 30-60 мин. После фильтрования сорбент отмывают дистиллированной водой до тех пор, пока рН промывной жидкости не достигнет рН воды.
Для освобождения от мелких и крупных частиц ионит суспендируют в мерном цилиндре на 1,0 л, перемешивают, отстаивают 20-30 мин и верхний слой жидкости с неосевшими мелкими частицами декантируют. Эту операцию повторяют несколько раз (5-6), пока жидкость над осадком будет свободной от мелкой взвеси. Чтобы освободиться от крупных частиц, ионит суспендируют в воде, перемешивают и примерно через одну минуту суспензию сливают в другой цилиндр.
После описанной обработки ионит уравновешивают буферным раствором, в котором осуществляют сорбцию белков на ионообменнике (исходный буферный раствор). Эту процедуру можно проводить как на колонке, так и вне ее. Обработку исходным буферным раствором осуществляют до тех пор, пока не произойдет выравнивания рН элюата на выходе из колонки (или жидкости, в которой суспендируют ионит) с рН исходного буферного раствора. Уравновешивание — процесс медленный. Для его ускорения ионит можно сначала обработать раствором того же состава, что и исходный, но с большей концентрацией, а после достижения нужного значения рН уравновешивание продолжают исходным раствором. Другой способ уравновешивания заключается; в том, что ионит суспендируют в исходном буферном растворе до получения достаточно жидкой суспензии. Добавлением раствора, содержащего соответственно кислый или основной компонент исходного буфера, доводят рН (на рН-метре) до нужного значения. Затем сорбент уравновешивают исходным буферным раствором. Во всех случаях конечное состояние равновесия (величину рН) необходимо контролировать.
Регенерация.Ионообменники можно использовать многократно. Поэтому по окончании работы их следует регенерировать. Для этого к использованному сорбенту добавляют 30-кратный объем 0,2-0,5 н. раствора NaOH, перемешивают до получения однородной суспензии и фильтруют на воронке Бухнера. Обработку щелочью проводят дважды. После этого ионит отмывают водой до нейтральной реакции фильтрата. Регенерированный ионообменник уравновешивают соответствующим буферным раствором.
Хранение.Ионообменники на основе целлюлозы и декстрана можно хранить во влажном состоянии непродолжительное время. Аниониты лучше хранить в солевой форме (не в ОН--форме), катиониты хранят в солевой форме и в Н+-форме. При хранении набухших ионообменников к ним добавляют антисептики; при добавлении толуола (нескольких капель на литр) следует помнить, что толуол поглощает при 280 нм, а растворимость его в некоторых буферах, например в трис-буфере, достаточно высока.
Подготовка и заполнение колонки.Колонку заполняют суспензией ионита в элюирующем буферном растворе, как описано выше. Заполнение колонки можно проводить и суспензией ионита в воде и лишь после уплотнения слоя сорбента уравновешивать колонку элюирующим буферным раствором. Над верхним слоем сорбента всегда должен оставаться слой жидкости не менее 2 см.
Подготовка исследуемого материала.Раствор белка, наносимый на колонку, должен иметь тот же состав и те же значения рН и ионной силы, что и исходный буферный раствор, которым уравновешен ионообменник. Образец переводят в исходный буферный раствор, подвергая его предварительно диализу или гель-хроматографии. Если объем пробы, предназначенный для ионообменной хроматографии, невелик, образец можно развести исходным буферным раствором. Нерастворимые компоненты удаляют центрифугированием или фильтрованием. Если исследуемый белок связывается с ионообменником прочно, объем наносимого белкового раствора значения не имеет, если он связывается слабо, наносимый объем должен быть по возможности небольшим.
Элюция белков с колонки. Скорость протекания элюента по колонке при ионообменной хроматографии сказывается на результатах разделения. При медленном токе жидкости, например порядка 8 мл/см2∙ч, разделение лучше, чем при токе жидкости через ту же колонку со скоростью 20 мл/см2∙ч. На разделительной способности колонки сказывается и крутизна создаваемого градиента элюции: чем круче градиент, тем острее пики на кривой элюции, однако лучшему разделению способствует более пологий градиент.
Опыт 1. Разделение белков сыворотки крови на ДЭАЭ-целлюлозе
ДЭАЭ-целлюлоза благодаря своим функциональным группам — диэтиламиноэтильным остаткам [-СН2-СН2-N=(С2Н5)2] — в водном растворе обладает свойствами слабого анионита. Используется для хроматографического фракционирования кислых и нейтральных белков.
Фракционирование белков сыворотки крови можно проводить с использованием градиентной или ступенчатой элюции. Сорбцию белков на колонке осуществляют при рН 5,65. При этом значении рН белки сыворотки крови могут сорбироваться на слабых анионитах.
Материалы и оборудование: комплект оборудования для хроматографии на колонках; спектрофотометр; 0,5 н. раствор НС1; 0,5 н. раствор NaOH; ДЭАЭ-целлюлоза; 0,02 М, 0,1 М и 0,5 М натрий-ацетатные буферные растворы рН 5,65; 0,3 н. раствор NaCl, приготовленный на 0,02 М натрий-ацетатном буферном растворе; 0,5 н. раствор NaCl, приготовленный на 0,5 М натрий-ацетатном буференом растворе.
Ход работы
Подготовка сорбента(проводится предварительно лаборантом). Около 10 г ДЭАЭ-целлюлозы обрабатывают и переводят в ОН—форму, как описано выше.
После освобождения от мелких частиц («отмучивания») обменник дважды суспендировать в избытке 0,1 М натрий-ацетатного буферного раствора (рН 5,65), выдерживая каждый раз в буфере по 30 мин. Избыток жидкости удалять декантацией. После второго суспендирования смесь внести в колонку[5].
Подготовку и заполнение колонки (1,5∙20 см) осуществлять, как описано в разделе «Общие приемы хроматографического разделения на колонках». Затем колонку уравновесить исходным элюирующим буферным раствором, медленно (при данных размерах колонки со скоростью 5-6 капель в 1 мин) пропуская 0,02 М натрий-ацетатный буфер (рН 5,65) через колонку до тех пор, пока рН выходящего из колонки раствора не будет равен исходному. Количество раствора, необходимого для уравновешивания, составляет около 8 общих объемов колонки.
Подготовка и нанесение исследуемого материала. Для удаления солей сыворотку крови диализовать против исходного буферного раствора. Для этого сыворотку развести в два раза исходным буферным раствором, поместить в диализный мешочек и диализовать против того же буфера в течение не менее 12 ч (можно оставлять на ночь). В отдиализированном растворе определить содержание белка и нанести на колонку 50-100 мг белка в объеме 1-3 мл. Колонку промыть исходным буферным раствором до тех пор, пока оптическая плотность не станет равной примерно 0,05.
Элюирование белков. Скорость протекания растворов через колонку не должна превышать 15-20 мл/ч. Элюат собирать порциями по 3 мл. Элюирование белков с колонки проводить буферными растворами с линейным градиентом NaCl, меняя концентрацию последнего от 0 до 0,3 М (прибор для создания линейного градиента см. на рис. 14). В смеситель поместить 250 мл 0,02 М натрий-ацетатного буферного раствора (рН 5,65), а в резервуар (сосуд 1) — 250 мл этого же раствора, но содержащего 0,3 М NaCl. Наиболее прочно адсорбированные белки дополнительно элюируют 0,5 М раствором NaCl в 0,5 М ацетатном буфере (рН 5,65).
Содержание белка во фракциях определять спектрофотометрически при длине волны 280 нм. На основании данных, полученных при определении содержания белка в отдельных порциях элюата, построить профиль элюции. Для этого построить график, на горизонтальной оси которого отложить номера пробирок (фракций) или объем прошедшей через колонку жидкости, а на вертикальной оси — величины оптической плотности фракций. Рассчитать процентное содержание белка в отдельных фракциях.
Для идентификации белков, элюируемых с колонки, содержимое пробирок, соответствующее отдельным пикам на кривой элюции, можно объединить, подвергнуть диализу, сконцентрировать (лиофилизацией, диализом против концентрированного раствора полиэтиленгликоля или ультрафильтрацией) и исследовать с помощью электрофореза на бумаге, в агарозном или полиакриламидном геле.
Опыт 2. Разделение белков сыворотки крови на КМ-целлюлозе
КМ-целлюлоза — слабый катионит. Содержит в качестве ионогенных групп карбоксиметильные остатки -СН2-СОО-, связанные с гидроксильными группами целлюлозы эфирными связями. Используется для разделения основных и нейтральных белков.
Фракц
