Подгруппа хрома - побочная подгруппа vi группы
Свойства элементов подгруппы хрома
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Атомный радиус, нм | Степень окисления |
| Хром Cr | [Ar] 3d54s1 | 7,2 | 1,56 | 0,125 | +1,+2,+3, +4,+5,+6 | |||
| Молибден Mo | [Kr] 4d55s1 | 10,2 | 1,3 | 0,135 | +1,+2,+3, +4,+5,+6 | |||
| Вольфрам W | [Xe] 4f145d46s2 | 19,3 | 1,4 | 0,141 | +1,+2,+3, +4,+5,+6 |
Физические свойства
Блестящие, сероватого цвета металлы. С увеличением атомного номера растут температуры плавления и кипения.
Вольфрам - самый тугоплавкий из известных металлов.
Химические свойства
В ряду Cr – Mo – W химическая активность падает.
С увеличением степени окисления элементов у их оксидов и гидроксидов законо-мерно происходит ослабление основных свойств и усиление кислотных. Высшим оксидам RO3 соответствуют кислоты H2RO4.
В том же направлении происходит усиление окислительных свойств соединений.
Хром и его соединения
Получение
1. Алюминотермия: Cr2O3 + 2Al ® Al2O3 + 2Cr
2. Восстановлением оксидов оксидом углерода (II).
3. Электролизом водных растворов соединений хрома.
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t°® 2Cr2O3
2Cr + 3Cl2 –t°® 2CrCl3
2Cr + N2 –t°® 2CrN
2Cr + 3S –t°® Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O « Cr2O3 + 3H2
Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl ® CrCl2 + H2
2Cr + 6HCl + O2 ® 2CrCl3 + 2H2O + H2
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Соединения двухвалентного хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl ® CrCl2 + 2H2O
Соединения хрома (II) - сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl ® 2CrCl3 + H2
4Cr(OH)2 + O2 + 2H2O ® 4Cr(OH)3
Соединения трёхвалентного хрома
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°® Cr2O3 + 3H2O
4K2Cr2O7 –t°® 2Cr2O3 + 4K2CrO4 + 3O2
(NH4)2Cr2O7 –t°® Cr2O3 + N2+ 4H2O
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH ® 2NaCrO2 + H2O
Cr2O3 + Na2CO3 ® 2NaCrO2 + CO2
Cr2O3 + 6KHSO4 ® Cr2(SO4)3 + 3K2SO4 + 3H2O
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
2Cr2O3 + 4KOH + KClO3 ® 2K2Cr2O7(дихромат калия) + KCl + 2H2O
Гидроксид хрома (III) Cr(OH)3 - нерастворимое в воде вещество зелёного цвета.
Cr2(SO4)3 + 6NaOH ® 2Cr(OH)3¯ + 3Na2SO4
Обладает амфотерными свойствами - растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3H2SO4 ® Cr2(SO4)3 + 6H2O
Cr(OH)3 + KOH ® K[Cr(OH)4]
(или, упрощая, Cr(OH)3 + KOH ® KCrO2(хромат калия) + 2H2O)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 ® 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 ® 6NaBr + 6NaCl + 8H2O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 - ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и H2SO4(конц.).
K2CrO4 + H2SO4 ® CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 ® 2CrO3 + K2SO4 + H2O
CrO3 - кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH ® K2CrO4 + H2O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4 ® K2Cr2O7 + K2SO4 + H2O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH ® 2K2CrO4 + H2O
| кислая среда | ||
| 2CrO42- + 2H+ | –––––––––––– ––––––––––––® | Cr2O72- + H2O |
| щелочная среда |
Все соединения хрома (VI) - сильные окислители. (Смотри тему "Окислительно-восстановительные реакции"):
4CrO3 + 3S ® 3SO2 + 2Cr2O3
ПОДГРУППА ЦИНКА
Свойства элементов II группы
побочной подгруппы (подгруппы цинка)
| Атомный номер | Название | Электронная конфигурация | Атомный радиус, нм | г/см3 | t°пл. °С | t°кип. °С | ЭО | Степени окисления |
| Цинк Zn | [Ar]3d104s2 | 0,132 | 7,13 | 419,4 | 1,6 | +2 | ||
| Кадмий Cd | [Kr]4d105s2 | 0,148 | 8,64 | 320,9 | 1,7 | +2 | ||
| Ртуть Hg | [Xe]4f145d106s2 | 0,15 | 13,59 | -38,8 | 1,9 | +1,+2 |
Физические свойства
1. Сходство элементов главной и побочной подгрупп во II группе больше, чем в I группе.
2. Значения плотности и атомного объема повышаются с увеличением атомной массы.
Химические свойства
1. Химическая активность уменьшается с увеличением атомной массы (в главной подгруппе –наоборот).
2. Хорошие комплексообразователи (в отличие от элементов главной подгруппы).
Цинк и его соединения
Цинк - металл серебристо-белого цвета. В соединениях проявляет только одну степень окисления +2; соединения цинка неокрашены.
Нормальный окислительно-восстановительный потенциал в кислой среде системы Zn2+ / Zn равен -0,76 в, а в щелочной среде системы ZnO22- / Zn равен -1,22 в. Поэтому цинк растворяется в разбавленных кислотах и щелочах
Zn + 2НCl ZnCl2 + H2
Zn + H2SO4(разб) ZnSO4 + H2
Zn + 2NaOH + 2H2O Na2[Zn(OH)4] + H2
Цинк не разлагает воду, т.к. в водном растворе он быстро покрывается защитной пленкой оксида, которая предохраняет его от коррозии.
Цинк - сильный восстановитель и вытесняет менее активные металлы (стоящие справа в ряду напряжений) из растворов их солей
Zn + CuSO4 ZnSO4 + Cu
Оксид цинка проявляет амфотерный характер, растворяясь как в кислотах, так и в растворах щелочей:
ZnO + H2SO4 ZnSO4 + H2O
ZnO + 2NaOH + H2O Na2[Zn(OH)4]
При нагревании комплексный тетрагидроксицинкат-анион дегидратируется:
[Zn(OH)4]2- ZnO22- + 2H2O
Гидроксид цинка также проявляет амфотерные свойства. Он нерастворим в воде, но растворяется в кислотах и щелочах;
Zn(OH)2 + 2HCl ZnCl2 + 2H2O
Zn(OH)2 + 2NaOH Na2[Zn(OH)4]
Ион Zn2+ является энергичным комплексообразователем с координационным числом 4. В отличие от гидроксида алюминия гидроксид цинка растворяется в водном растворе аммиака:
Zn(OH)2 + 2NH3 [Zn(NH3)4](OH)2
Кадмий и его соединения
Кадмий - белый, блестящий, мягкий, ковкий металл; очень мало растворяется в неокисляющих кислотах, хорошо растворяется в разбавленной HNO3 (нормальный потенциал Cd / Cd 2+ = -0,40 в).
Кадмий образует только один ряд соединений, где он двухвалентен. Ион Сd 2+ - бесцветен.
Оксид кадмия СdО (коричневого цвета) и гидроксид кадмия Сd(ОН)2 (белого цвета) проявляют основной характер, растворяясь только в кислотах.
CdO + 2HCl CdCl2 + H2O
(CdO + 2H+ Cd2+ + H2O)
Cd(OH)2 + 2HCl CdCl2 + 2H2O
(Cd(OH)2 + 2H+ Cd 2+ + 2H2O)
Кадмий является хорошим комплексообразователем (координационное число 4). Гидроксид кадмия растворяется в водном растворе аммиака:
Cd(OH)2 + 4NH3 [Cd(NH3)4](OH)2
Ртуть и ее соединения
Ртуть - серебристо-белый, блестящий, единственный жидкий при комнатной температуре металл; обладает низкой электропроводностью (она составляет 1,7% от электропроводности серебра) и большим коэффициентом термического расширения. На воздухе проявляет устойчивость. Реагирует с серой и галогенами:
Hg + S HgS
Hg + Br2 HgBr2
Со многими металлами дает сплавы (амальгамы) (экзотермическое образование). Пары и соединения чрезвычайно ядовиты (накапливаются в организме).
Ртуть не растворяется в соляной и разбавленной серной кислотах (в ряду напряжений металлов ртуть находится после водорода; нормальный потенциал Hg / Hg 2+ = +0,85 в). Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II):
Hg + 4HNO3 Hg(NO3)2 + 2NO2 + 2H2O
При растворении ртути в разбавленной азотной кислоте образуется нитрат ртути (I),
6Hg + 8HNO3 3Hg2(NO3)2 + 2NO + 4H2O
При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути:
Hg + 2H2SO4 HgSO4 + SO2 + 2H2O
2Hg + 2H2SO4 Hg2SO4 + SO2 + 2H2O
Ртуть растворяется в царской водке:
3Hg + 2HNO3 + 6HCl 3HgCl2 + 2NO + 4H2O
Оксид ртути (II) HgO; красный кристаллический или желтый аморфный порошок; плохо растворим в воде; раствор имеет слабо щелочную реакцию.
Получение
| 3000 C | ||
| 2Hg + O2 | ––® | 2HgO |
| 4000 C |
Hg2(NO3)2 2HgO + 2NO2
2Hg(NO3)2 2HgO + 4NO2 + O2
Hg 2+ + 2OH- HgO + H2O
Химические свойства.
Легко восстанавливается; при нагревании разлагается на ртуть и кислород. Реагирует с кислотами с кислотами с образованием солей и воды.
Сульфид ртути (II) HgS (киноварь) – ярко-красный нерастворимый в воде порошок.
Hg + S HgS
Hg2+ + S2- HgS
Галогениды ртути (II)
Получение
Hg + Br2 HgBr2
HgO + 2HCl(сулема) HgCl2 + H2O
Сулему также получают растворением ртути в царской водке.
Химические свойства:
HgI2 + 2KI K2[HgI4](реактив Несслера)
Реактив Несслера используется в качестве очень чувствительного аналитического реагента для обнаружения иона NH4+:
2[HgI4]2- + NH4+ + 4OH- [ 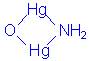 ]+(коричневый осадок) I- + 7I- + 3H2O
]+(коричневый осадок) I- + 7I- + 3H2O
Сульфат ртути (II) и нитрат ртути (II).Получают растворением ртути или оксида ртути (II) в концентрированных серной или азотной кислотах соответственно.
Hg + 2H2SO4(горячая,конц.) HgSO4 + SO2 + 2H2O
HgO + H2SO4 HgSO4 + H2O
3Hg + 8HNO3(конц.) 3Hg(NO3)2 + 2NO + 4H2O
HgO + 2HNO3 Hg(NO3)2 + H2O
Более активные металлы легко вытесняют ртуть из ее солей:
Cu + Hg(NO3)2 Cu(NO3)2 + Hg
