Подгруппа меди – побочная подгруппа I группы
Свойства элементов подгруппы меди
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Атомный радиус, нм | Удельная злектро- проводность м,мм-2,ом-1 | Степень окисления |
| Медь Cu | [Ar] 3d104s1 | 8,96 | 1,9 | 0,127 | 58,1 | +1,+2 | |||
| Серебро Ag | [Kr] 4d105s1 | 10,5 | 1,9 | 0,144 | 61,0 | +1 | |||
| Золото Au | [Xe]4f145d106s1 | 19,3 | 2,4 | 0,144 | 41,3 | +1,+3 |
Физические свойства
1. Высокие значения плотности, температур плавления и кипения.
2. Высокая тепло- и электропроводность.
Химические свойства
Химическая активность небольшая, убывает с увеличением атомного номера.
Медь и её соединения
Получение
1. Пирометаллургия
CuO + C ® Cu + CO
CuO + CO ® Cu + CO2
2. Гидрометаллургия
CuO + H2SO4 ® CuSO4 + H2O
CuSO4 + Fe ® FeSO4 + Cu
электролиз:
2CuSO4 + 2H2O ®2Cu + O2+ 2H2SO4
(на катоде) (на аноде)
Химические свойства
Взаимодействует с неметаллами при высоких температурах:
2Cu + O2 –t°® 2CuO
Cu + Ci2 –t°® CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 2H2O
Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
Cu + 2H2SO4(конц.) ® CuSO4 + SO2 +2H2O
Сплавы меди с оловом - бронзы, с цинком - латуни.
Соединения одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 ® [Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде:
2CuSO4 + C6H12O6 + 5NaOH ® Cu2O¯ + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах:
CuO + H2SO4 –t°® CuSO4 + H2O
CuO + 2HNO3 –t°® Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH ® Cu(OH)2¯ + Na2SO4
При нагревании чернеет, разлагаясь до оксида:
Cu(OH)2 –t°® CuO + H2O
Типичное основание. Растворяется в кислотах.
Cu(OH)2 + 2HCl ® CuCl2 + 2H2O
Cu(OH)2 + 2H+ ® Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу):
Cu(OH)2 + 4NH3 ® [Cu(HN3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции:
2CuSO4 + 2Na2CO3 + H2O ® Cu2(OH)2CO3¯ + 2Na2SO4 + CO2
Разложение малахита:
Cu2(OH)2CO3 –t°® 2CuO + CO2 + H2O
Серебро и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра происходит реакция Гепара:
4Ag + 2H2S + O2 ® 2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в кислотах - окислителях:
3Ag + 4HNO3(разб.) ® 3AgNO3 + NO + 2H2O
Ag + 2HNO3(конц.) ® AgNO3 + NO2+ H2O
2Ag + 2H2SO4(конц.) ® Ag2SO4 + SO2 + 2H2O
В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- ® AgCl¯ белый
Ag+ + Br- ® AgBr¯ светло-жёлтый
Ag+ + I- ® AgI¯ тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH ® Ag2O + 2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 ® [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O ® 2[Ag(NH3)2]OH
Аммиачные комплексы серебра взаимодействуют с альдегидами (реакция серебряного зеркала):
| O II | O II | |||
| R – | C | + [Ag(NH3)2]OH ® R– | C | + Ag¯ + NH3 |
| I H | I O | NH4 |
Золото и его соединения
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу; благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим только в смеси концентрированных соляной и азотной кислот ("царской водке"):
Au + HNO3 + 4HCl ® H[AuCl4] + NO + 2H2O
Реагирует с галогенами при нагревании:
2Au + 3Cl2 ® 2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с выделением металла. Комплексообразователь (комплексы золота (III) обладают координационными числами 4, 5 и 6).
ПОДГРУППА МАРГАНЦА
Подгруппа марганца
Побочная подгруппа VII группы
Свойства элементов подгруппы марганца
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Атомный радиус, нм | Степень окисления |
| Марганец Mn | [Ar] 3d54s2 | 7,45 | 1,6 | 0,131 | +2,+3,+4, +5,+6,+7 | |||
| Технеций Tc | [Kr] 4d55s2 | 11,5 | 1,36 | 0,136 | +2,+3,+4, +5,+6,+7 | |||
| Рений Re | [Xe] 4f145d56s2 | 20,53 | 1,46 | 0,137 | +3,+4,+5, +6,+7 |
Физические свойства
Серебристо-белые, тугоплавкие металлы.
Химические свойства
1. В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H+ ® Mn2+ + H2
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3 ® 3HTcO4 + 7NO + 2H2O
2. С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Марганец и его соединения
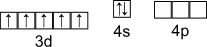
Марганец
Электронная конфигурация валентного слоя
Получение
Алюмотермия: 3MnO2 + 4Al ® 2Al2O3 + 3Mn
Химические свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S ® MnS
Растворяется в кислотах:
Mn + 2HCl ® MnCl2 + H2
(При этом образуются соединения двухвалентного марганца).
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2 ® MnO + H2O
Гидроксид марганца (II) Mn(OH)2 - светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH ® Mn(OH)2¯ + Na2SO4
Mn2+ + 2OH- ® Mn(OH)2
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl ® MnCl2 + 2H2O
Mn(OH)2 + 2H+ ® Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O ® 2[MnO2 • 2H2O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO4-:
2Mn(OH)2 + 5Br2 + 12NaOH –кат.CuSO4® 2NaMnO4 + 10NaBr + 8H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 ® 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 ® 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
(смотри тему "Окислительно - восстановительные реакции", упражнения 3 и 7).
Оксид марганца (IV) MnO2 - тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2 –t°® MnO2 + 2NO2
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C).
Сильный окислитель:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного цвета:
MnO2 + Na2CO3 + NaNO3 –t°® Na2MnO4 + NaNO2 + CO2
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH ® Na2SO4 + 2K2Mn+6O4 + H2O
Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2H2O « 2KMnO4 + MnO2 + 4KOH
| MnO2 | MnO42- | MnO4- | ||||
 | SO32- –– |  | Cl2 ––® |  | ||
| раствор ® | раствор | раствор | ||||
| бурый осадок | H+¯OH- | |||||
| раствор® |  бурый осадок бурый осадок |
3MnO42- + 2H2O « 2MnO4- + MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют "минеральным хамелеоном".
Оксид марганца (VII) Mn2O7 - тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4 ® Mn2O7¯ + K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH ® 2KMnO4 + H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
2KMnO4 –t°® K2MnO4 + MnO2 + O2
Сильный окислитель, причём восстанавливается в кислой среде до Mn2+, в нейтральной – до Mn+4O2, а в щелочной – до Mn+6O42-.
(смотри тему "Окислительно-восстановительные реакции")
ПОДГРУППА ХРОМА
