Занятие 12. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ. Осмос и осмотическое давление
Цель занятия:
Сформировать системные знания о коллигативных свойствах разбавленных растворов; научиться использовать закон Вант-Гоффа для расчета соответствующих параметров разбавленных растворов, в том числе биологических жидкостей.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Постановка демонстрационных опытов.
Вопросы, предлагаемые для обсуждения на занятии:
1. Диффузия в растворах. Факторы, влияющие на скорость диффузии. Закон Фика. Роль диффузии в процессах переноса вещества в биологических системах.
2. Сущность осмоса. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа. Гипо-, гипер- .и изотонические растворы. Измерение осмотического давления.
3. Отклонение растворов электролитов от закона Вант-Гоффа. Изотонический коэффициент, его связь со степенью диссоциации электролита. Понятие об осмотической концентрации растворов.
4. Осмотическое давление растворов биополимеров. Осмотическое давление плазмы и сыворотки крови и его биологическая роль.
5. Роль осмоса и осмотического давления в биологических системах. Изоосмия организмов. Формирование отека. Плазмолиз, гемолиз. Применение в медицине гипер- и изотонических растворов.
Лабораторная работа
Выполнение демонстрационных опытов (в процессе обсуждения теоретического материала).
Опыт 1. Определение осмотического давления раствора сахарозы.
Осмометр вынимают из штатива. Затем, наклонив его в сторону боковой (широкой) трубки, через отверстие этой трубки с помощью пипетки заполняют исследуемым раствором сахара. Продолжая держать осмометр в наклоненном положении, боковую (широкую) трубку плотно закрывают пробкой так, чтобы в ней не оставалось пузырьков воздуха, а уровень раствора в капилляре был возможно ниже. Заполненный осмометр погружают в стакан с дистиллированной водой до нижнего уровня капилляра и закрепляют в штативе. Если в течение первых 30 минут высота раствора в капилляре не увеличится, заменяют осмометр. Через 1.5–2 часа от начала опыта (когда осмос прекратится) измеряют высоту подъема раствора в капиллярной трубке от поверхности воды в стакане. Осмотическое давление раствора рассчитывают по формуле:
Росм. = h∙ ρ∙ g (Па)
где: h – высота подъема раствора в капилляре (м);
ρ– плотность исследуемого раствора (кг/м3);
g – ускорение свободного падении я тела, (м/с2).
Результаты опыта оформляют в виде таблицы, приводя подробный рисунок осмометра и расчет осмотического давления.
| Продолжительность осмоса | h, м | ρ, кг/м3 | Р, Па |
Опыт 2. Рост искусственной «клетки» Траубе.
В цилиндр наливают 150–200 мл раствора СиSО4 и бросают кристаллик К4[Fe(CN)6]. За счет реакции
2 CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2 K2SO4
на поверхности кристалла образуется сплошная пленка гексацианоферрата(II) меди, пропускающая воду, но задерживающая частицы солей. Вследствие равности концентраций внутри оболочки и вне ее вода начинает поступать внутрь «клетки». Оболочка растягивается и разрывается в самом слабом месте. На этом месте вновь возникает пленка из Cu2[Fe(CN)6], и так постепенно развивается вытянутая полость, очертаниями напоминающая водоросль или гидру.
Опыт 3. Гемолиз эритроцитов.
Берут 3 пробирки. В первую наливают из бюретки 3 мл дистиллированной воды, во вторую (пипеткой) 3 мл раствора хлорида натрия с массовой долей NaCl 0.2%, в третью (пипеткой) – 3 мл раствора хлорида натрия с массовой долей NaCl 0.9%; в каждую пробирку вносят по 2 капли крови и встряхивают.
Через полчаса отмечают, в каких пробирках произошел гемолиз эритроцитов.
Работу оформляют в виде таблицы.
| Содержание пробирки | Что наблюдали | Вывод (отсутствие или наличие гемолиза) |
| 3 мл Н2О + 2 капли крови 3 мл р-ра NaCL c ω = 0.2 % + 2 капли крови 3 мл р-ра NaCL c ω = 0.9 % + 2 капли крови |
Контрольные вопросы и задачи
1. Какие свойства растворов называются коллигативными?
2. Что такое полупронецаемые мембраны? Приведите примеры полупроницаемых мембран.
3. Дайте определение осмоса и осмотического давления. Какие существуют методы определения осмотического давления?
4. Какое из перечисленных утверждений верно: при одинаковой молярной концентрации и температуре максимальное осмотическое давление имеет разбавленный раствор:
а) хлорида натрия; б) хлорида калия; в) хлорида кальция,
г) глюкозы.
5. Будут ли изотоничны водные растворы двух нелетучих неэлектролитов, если температуры и молярные концентрации растворов одинаковы? Ответ мотивируйте.
6. Будут ли изотоничны водные растворы двух нелетучих неэлектролитов (М1 > М2), если температуры растворов и массовые доли этих веществ в растворах одинаковы? Если, на ваш взгляд, растворы неизотоничны, то в котором из них — первом или втором — осмотическое давление выше? Почему?
7. Как будет меняться во времени осмотическое давление подкисленного раствора сахарозы при 80°С? Ответ мотивируйте.
8. Опишите поведение эритроцитов при 37°С в водных растворах следующих веществ:
а) фруктозы, ω = 2%, плотность 1.006 г/мл;
б) сульфата натрия, ω = 16%, плотность 1.151 г/мл, α = 1;
в) мочевины, С = 0.3 моль/л.
9. Раствор, полученный растворением 50 г органического вещества в 1300 мл воды обладает при 20°С осмотическим давлением 0.01 атм и плотностью 1.01 г/мл. Определите молярную массу органического вещества.
10. Какую массу глюкозы следует взять для приготовления
0.5 л водного раствора, изотоничного плазме крови при температуре 37°С?
11. При 20°С смешали 1 л раствора сахарозы, осмотическое давление которого 2.4 атм с 3 л раствора KCl, осмотическое давление которого 4.8 атм. Найти осмотическое давление смешанного раствора, если αHCl = 1.
12. Будут ли изотоничны плазме крови при температуре 37°С следующие растворы:
а) 5%-й водный раствор глюкозы (ρ = 1.08 г/моль);
б) водный раствор, содержащий в 0.1 л раствора дезоксирибозу массой 1.34 г;
в) раствор фруктозы с молярной концентрацией 0,303 моль/л;
г) водный раствор карбоната калия с массовой долей К2СО3 0.7% и плотность 1.005 г/мл (αК2СО3 = 1).
13. Рассчитайте осмотическое давление при 37°С
(R = 0,082 л·атм/К):
а) 0.1 М раствора СаCl2 (αСаCl2 = 1)
б) внутриклеточной жидкости, если состав раствора (моль/л): [Na+] =35; [K+] =115; [Ca2+] =5; [Clˉ] = 20; [HCO3ˉ] = 20; [H2PO4ˉ] = 100; [SO42-] =10.
в) раствора, в 2 л которого содержится 90 г глюкозы
(М =180 г/моль).
Занятие 13. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.
закон рауля
Цель занятия:
Сформировать системные знания о коллигативных свойствах разбавленных растворов; научиться использовать закон Рауля для расчета соответствующих параметров разбавленных растворов, в том числе биологических жидкостей.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме.
2. Решение задач.
3. Тестовый контроль по теме «Коллигативные свойства растворов».
Вопросы, предлагаемые для обсуждения на занятии:
1. Насыщенный пар, давление насыщенного пара над чистым растворителем. Относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего неэлектролита; закон Рауля.
2. Температуры кипения и замерзания растворов. Относительное повышение температуры кипения и понижение температуры замерзания (депрессии) разбавленных растворов неэлектролитов по сравнению с чистыми растворителями; следствия из закона Рауля. Эбуллиоскопическая и криоскопическая постоянные, их физический смысл.
3. Отклонение растворов электролитов от закона Рауля и его следствий. Изотонический коэффициент.
4. Взаимосвязь между коллигативными свойствами растворов. Осмометрия, криометрия и применение их в медико-биологических исследованиях.
Контрольные вопросы и задачи
1. Объясните с помощью принципа смещения химического равновесия повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем.
2. Что называется давлением насыщенного пара? Как оно изменяется над раствором по мере увеличения концентрации нелетучего неэлектролита?
3. Не производя расчетов, укажите, какой из трех растворов с одинаковой массовой долей – хлорида бария, хлорида магния, хлорида кальция – имеет минимальную и максимальную температуру замерзания. Ответ мотивируйте.
4. Барбитуровая кислота, производные которой имеют большое значение в медицине, состоит (по массе) из 42.11 % углерода, 3.58% водорода, 42.11% кислорода и 12.28% азота. Температура кипения раствора, содержащего 10.21 г барбитуровой кислоты в 360 г ССl4, на 1.25 К выше температуры кипения чистого ССl4. Какова молярная масса и молекулярная формула барбитуровой кислоты (ЕССl4 = 5.02).
5. Многие моносахариды отвечают простейшей формуле Сn(H2O)n. Выведите молекулярную формулу ксилозы, водный раствор которой с массовой долей вещества 1.96% замерзает при -0,248°С.
6. Чему равна температура замерзания водного раствора, содержащего глюкозу с массовой долей 3%, если Кводы = 1,86.
7. Какую массу сахарозы следует растворить в 250 г воды, чтобы получить раствор, кипящий при 100.2°С. При какой температуре будет замерзать этот раствор?
8. Понижение температуры замерзания плазмы крови равно 0.56°С. Рассчитайте массу воды, которую необходимо добавить к 100 г 10% раствора NaCl, для получения раствора, изотоничного крови при 37°С.
9. Как можно вычислить величину осмотического давления раствора нелетучего неэлектролита, если известна депрессия (∆Тзам.) раствора?
Занятие 14. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ рН
Цель занятия:
Научиться составлять схему гальванического элемента, представлять электронные уравнения процессов, протекающих на электродах. Научиться определять рН исследуемых растворов.
Содержание занятия:
1. Обсуждение теоретических вопросов по теме занятия.
2. Решение задач.
3. Выполнение лабораторной работы.
Вопросы, предлагаемые для обсуждения на занятии:
1. Сущность метода потенциометрии и его медико-биологическое значение.
2. Механизм возникновения электродного потенциала.
3. Уравнение Нернста. Зависимость электролитного потенциала от различных факторов. Стандартный электродный потенциал. Ряд напряжений металлов.
4. Классификация электродов.
5. Устройство электродов I и II рода. Стеклянный и хлорсеребряный электроды.
6. Гальванический элемент: схема, электродные реакции, расчет ЭДС.
7. Редокс-электроды. Уравнение Петерса. Биологическое значение редокс-потенциала
8. Диффузные и мембранные потенциалы, их биологическое значение.
Лабораторная работа
Потенциометрическое определение рН исследуемого раствора при помощи стеклянного электрода
При измерении рН растворов с помощью приборов «ЭВ-74», «рН-340», «рН-121» составляют гальванический элемент из стеклянного и хлорсеребряного электродов, погруженных в исследуемый раствор.
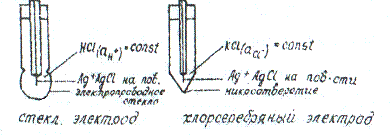
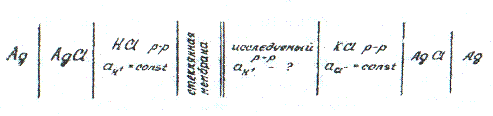
Схема гальванического элемента
Указания для выполнения и оформления работы
(иономер ЭВ- 74)
I. Включение прибора(его следует включить за 30 мин до начала работы).
1. Проверить заземление прибора – клемма на задней стенке прибора должна быть присоединена к линии заземления.
2. Нажать клавиши «t°» и «-1÷19» на лицевой панели прибора.
3. Подключить прибор к сети 220 V с помощью шнура и включить тумблер «сеть» на лицевой панели прибора. При этом должна засветиться индикаторная лампочка.
II. Подготовка гальванического элемента к работе– через 15 мин после включения прибора.
1. Получить у преподавателя исследуемый раствор.
2. Аккуратно приподнять вверх стаканчик с дистиллированной водой, в который опущены электроды и термометр, отвести в сторону поворотный столик – подставку и освободить электроды, опустив стакан вниз.
3. В чистый стакан налить до отметки исследуемый раствор и промыть им электроды, осторожно поднимая вверх стаканчик с раствором и стараясь при этом не касаться электродов.
4. Вылить из стаканчика исследуемый раствор, налить до отметки новую порцию его, ввести электроды в раствор, столик – подставку вернуть в начальное положение и поставить на него стакан. Электроды при этом должны быть погружены в раствор на 2 см.
5. Проверить подключение гальванического элемента к прибору «ЭВ-74»: штекер, которым заканчивается тонкий провод от вспомогательного электрода, должен быть подключен до упора в гнездо «всп» на задней стенке прибора, а штекер, которым заканчивается толстый кабель от измерительного электрода, подключен до упора в гнездо «изм», расположенное рядом с гнездом «всп».
III. Установка температуры раствора
1. Проверить установку переключателя рода термокомпенсации на задней стенке прибора в положении «ручн». Такое включение необходимо при работе с растворами, имеющими комнатную температуру (20±10°С).
2. Нажать клавишу малого диапазона «14÷19».
3. Ручкой « температура раствора» на лицевой панели установить по верхней шкале показывающего прибора (оцифровка 0÷100) температуру, соответствующую показаниям термометра, погруженного в исследуемый раствор.
IV. Определение рН (его следует проводить через 10 мин после подготовки гальванического элемента к работе и все полученные данные сразу же внести в таблицу).
1. Нажать клавиши «анионы/катионы», «рН» и «-1÷19» на лицевой панели прибора.
2. По нижней шкале показывающего прибора (оцифровка -1÷19) найти и записать отсчет (рН ориентировочное).
3. Нажать клавишу одного из узких диапозонов рН (-1÷4; 4÷ 9; 9÷14; 14÷19), в пределах которого находится рН ориентир.
Внимание!Дальнейшее определение и расчет рН исследуемого раствора проводят по-разному (п. 4 или п. 5) в зависимости от выбранного узкого диапазона.
4. Если нажата клавиша «-1÷4», то по верхней шкале прибора (оцифровка «-1÷4») находят отсчет с точностью до сотых долей единицы и записывают его (рНиссл.). Отключают узкий диапазон, нажав клавишу «-1÷19». Повторяют определение отсчета еще 2 раза, затем приглашают преподавателя к рабочему месту для проверки показаний прибора и результата работы
5. Если нажата одна из клавиш «4÷9», «9÷14», «14÷19», то по верхней шкале (оцифровка 0÷5) находят отсчет с точностью до сотых долей единицы и записавают его (рН1). Отключают узкий диапазон, нажав клавишу «1÷19». Повторяют определение отсчета еще 2 раза. Расчет рН исследуемого раствора (рНиссл.) выполняют по формуле:
рНиссл. = рНнач. + рН1,
где рНнач — значение рН, соответствующее началу выбранного узкого диапазона. Затем к рабочему месту приглашают преподавателя для проверки показаний прибора и результата работы.
V. Окончание работы.
1. Отключить тумблер «сеть» на лицевой панели прибора, выключить прибор из сети.
2. Осторожно заменить в гальваническом элементе стаканчик с исследуемым раствором на стаканчик с дистиллированной водой, аккуратно приподняв стакан вверх и отводя в сторону столик–подставку.
3. Оформить отчет по работе. При оформлении работы:
а) привести подробные схемы рисунков стеклянного и хлорсеребряного электродов, схему исследуемого гальванического элемента.
б) Привести таблицу.
| 1. Температура растворы | t, °C |
| 2. Широкий диапазон измерения рН | -1 ÷ 19 |
| 3. Отсчет по шкале широкого диапазона | pHориент. |
| 4. Узкий диапазон измерения рН (соответствует положению тумблера «пределы измерения») | |
| 5. Отсчеты по шкале узкого диапазона «рН» с точностью до сотых долей еденицы | 1. 2. 3. рН1(ср.) = |
| 6. рНиссл. = рНнач. + рН1, где рНнач – значение рН, соответствующее началу выбранного узкого диапазона. | рНиссл. = |
Контрольные вопросы и задачи
1. Рассчитайте электродные потенциалы магния в растворе его соли при концентрации иона Mg2+ 0,1; 0,01 и 0,001 моль/л при температуре 25°C.
2. Приведите схему медно-никелевого гальванического элемента, определите знаки электродов, составьте уравнения реакций, протекающих на электродах, выведите формулу ЭДС и рассчитайте ЭДС данного гальванического элемента, если С (Cu2+) = 10-2 моль/л, а С (Ni2+) = 10-4 моль/л.
3. В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
а) Mg | Mg2+|| Pb2+ | Pb
б) Pb | Pb2+ || Cu2+ | Cu
в) Сu | Cu2+ || Ag+ | Ag
4. Потенциал водородного электрода в некотором растворе равен -118 мВ. Вычислите активность ионов водорода в этом растворе.
5. Никелевые пластины опущены в растворы NiSO4 c концентрациями 0.01 и 0.05 моль/л. Привести схему данного гальванического элемента, электродные реакции, рассчитать ЭДС.
6. Приведите схемы гальванических элементов, с помощью которых можно определить стандартный электродный потенциал металла.
