Общие свойства растворов(температура замерзания и кипения растворов,давление пара растворителя над раствором,осмотическое давление)
Понижение давления пара растворителя над раствором: при данной температуре давления насыщенного пара над жидкостью это постоянная величина.При растворении в воде какого либо твердого ,нелетучего вещ-а давление насыщенного пара этой жидкости понижается.Таким образом давление насыщенного пара раствора над растворителем всегда меньше чем над чистым раствором дельта р=р0-р-абсолютное понижение давления пара. Дельта р/р0-относительное понижение давления пара.По закону Рауля относительное понижение давления пара растворителя над раствором =мольной доли вещ-а.Давление пара растворителя над раствором зависит от природы растворителя, молярной доли растворенного вещества,но не зависит от природы растворенного вещества.Понижение температуры замерзания и повышение температуры кипения: температура кипения раствора содержащего нелетучее растворенное вещество всегда выше чем чистого растворителя.Температура замершего раствора содержащего нелетучее растворенное вещество всегда ниже,чем чистого растворителя.Осмотическое давление:диффузией называют стремление вещ-а равномерно распределяться по всему объему раствора,что приводит к выравниванию концентраций.Разделим раствор и растворитель пленкой через которую проходят молекулы растворителя,но не проходят молекулы растворенного вещества.Процесс односторонней диффузии растворителя через полупроницаемую мембрану назыв. Осмосом.Осмотическим назыв.то давление которое необходимо приложить к раствору чтобы прекратить осмос.Осмотическое давление не зависит от природы растворенное вещества и раствора.По закону Вангофа осмотическое давление зависит от концентрации и давления. Росм.=С*R*T,где Т-температура,С-молярная концентрация,R-молярная масса. Росм.=(m/M*V)*RT
33.Растворы электролитов.Изотонический коэффициент.Основные положения теории электролитической диссоциации. Вещества распадающиеся в расплавах или в растворах на ионы и проводимые ток назыв.электролиты.К электролитам относят соли,кислоты,щелочи.Вещ-а которые в тех же условиях на ионы не распадаются и электрический ток не проводят назыв.неэлектролитами.к ним относятся большинство органических соединений.Для растворов электролитов осмотическое давление ниже давления пара ,изменения температуры кипения и замерзания оказываются выше ,чем это отвечает концентрации раствора.Чтобы распространить на на электролиты расчетные формулы данных законов был введен изотонический коэффициент i=P'осм/
Росм.=дельта t’кип./дельта tкип.=дельта р'/дельта р=дельта t’замерз/дельта t замерз.Теория электролитической диссоциации: 1) электролиты в расплавах или в водном растворе подвергаются ионизации т.е распадаются на положительно и отрицательно заряженные ионы.Положительно заряженные ионы называются катионами к ним относятся ионы металлов и ион водорода.Отрицательно заряженные ионы назыв.анионы,к ним относятся кислотные остатки и ОН 2)В следствии электролитической диссоциации водные растворы электролитов проводят электрический ток.Электропроводность в водных растворах электролитов пропорциональна общей концентрации ионов в растворе. 3)Возможность и степень распада на ионы определяется природой растворенного вещества и растворителя.При растворении ионных соединений происходит диссоциация т.к. ионные соединения уже состоят из ионов.Электролиты можно разделить на 2 группы:истинные электролиты(вещ-а имеющие ионую кристаллическую решетку) и потенциальные электролиты(вещ-а имеющие молекулярную структуру)
34.Равновесие в растворах электролитов.Степень электролитической диссоциации.Сильные и слабые электролиты.Для количественной характеристики процесса диссоциации было введено понятие степени диссоциации(a),это отношение числа диссоциирующих молекул (n) к общему числу растворенных молекул(n0)По степени диссоциации все электролиты делят на слабые если a < 3% ,средние если a от 3 до 30 процетов и сильные если a> 30%К сильным электролитам относят:растворенные в воде соли,основания щелочных и щелочноземельных металлов,кислоты.На степень диссоциации влияет природа растворителя,концентрация раствора,наличие одноименных ионов.Добавление одноименных ионов уменьшает диссоциацию слабых ионов.При растворении электролитов в растворах электролит диссациирует на ионы,в следствии чего число частиц в растворе становится больше по сравнению с раствором электролитом.
35.Константа диссоциации.Закон разбавления Оствальда. Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы.Диссоциация слабых электролитов это обратный процесс.Константа диссоциации-константа равновесия процесса диссоциации.Кдис.зависит от природы электролита от природы растворителя,от температуры .Константа диссоциации указывает на прочность молекул в данном растворе.Чем она меньше тем слабее диссоциация,тем меньше ионов в растворе. К дис.=[K]*[A]/[KA]=Ca*Ca/C-Ca=Ca2/1-a-закон разбавления Оствальда,где
a-степень диссоциации,С-концентрация слабого электролита в растворе.Степень диссоциации уменьшается с увеличением концентрации слабого электролита или степень диссоциации увеличивается по мере разбавления раствора
36.Теория сильных электролитов.Активность ионов,ионная сила раствора.
Сильные электролиты диссоциируют практически полностью.Недиссоциируемые молекулы отсутствуют ,степень диссоциации =1.Однако свойства растворов сильных электролитов не соответствует о их полной диссоциации.Измеряемая степень диссоциации может быть меньше 1 и стремиться к 1 лишь при бесконечном разбавлении.Эксперементальное определение степени диссоциации назыв.кажущейся степенью диссоциации.Ионы электролита взаимодействуют не только с растворителем но и друг с другом.Вокруг каждого иона в растворе создается ионная атмосфера,тоесть ионное облако состоящее из ионов с противоположным знаком заряда.Возникает эффект уменьшения ионов участвующих в химическом процессе.При движении ионов окружающая его ионная атмосфера тормозит движение и уменьшаетр подвижность ионов.Чем больше концентрация раствора тем сильнее проявляются тормозящие действия ионой атмосферы.Применять уравнение для константы диссоциации к сильным электролитам оказалось возможным при замене значения концентрации на активность.а-активность иона т.е эффективная концентрация иона соответственно которой он действует в химических реакциях.f-коэффициент активности учитывающий все все виды взаимодействия частиц в растворе f стремится к 1 лишь при бесконечном разбавлении,зависит от температуры,природы растворителя,растворенного вещества и от концентрации.Коэффициент активности данного иона зависит от его заряда и от ионной силы раствора(m)под которой понимают полусумму произведений концентраций всех находящихся в растворе ионов на квадрат их заряда.
37.Кислоты, основания,соли с точки зрения теории электролитической диссоциации. Ступенчатая диссоциация кислот и оснований. Характер диссоциации средних, кислых основных, двойных солей. Амфотерные электролиты. Изменение кислотно-основных свойств соединения элементов.Кислотой назыв.электролит кот.диссоциируют с образованием ионов водорода.
Чем больше константа диссоциации кислоты тем она сильнее. Многоосновные кислоты диссоциируют ступенчато
Константа полной диссоциации = проиведению константы соответствующих отдельным стадиям. Основанием назыв.электролит который диссоциирует с образованием гидроксил ионов ОН………………..
Многокислотные основания диссациируют ступенчато
Электролиты которые диссоциируют и как кислоты и как основания назыв.амфотерными.
Соли:
Кислые соли:
Основные:
Двойные соли:
Смешанные:
Комплексные:
38.Ионное произведение воды.Водородный показатель.Ионное произведение воды - произведение концентраций ионов водорода Н+ и ионов гидроксида OH- в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O - H3O+ + OH−
или
H2O - H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
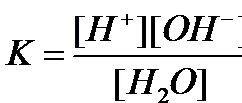
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации
Водоро́дный показа́тель, pH - мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр.
Расчет: pH=-lg[H+]
pH кислых растворов pH < 7, pH щелочных растворов pH > 7, pH нейтральных растворов равен 7.
39.Реакции в растворах электролитов как реакции ионного обмена,условия их протекания.Реакция нейтрализации. Реакции между электролитами в растворе это реакции между ионами.Сильные электролиты в разбавленных растворах практически поностью ионизируют ,поэтому уравнения реакции записанные в молекулярной форме для реакции в растворах не применимы т.к не дают возможности судить о направлении процесса.Реакция между электролитами в растворе возможна т.е необратимо протекает если один из продуктов реакции выделяется в виде газа или осадка или явл.слабым электролитом.Ионные реакции записываются с помощью ионно-молекулярных уравнений,полных и сокращенных.При этом сильные электролиты записываются в види ионов в молекулярной форме записывают нерастворимые вещ-а,газообразные веще-а и слабые электролиты.
Взаимодействие между кислотами и основаниями в результате которого образуется соль и вода назыв.реакцией нейтрализации.Нейтрализация доходит до конца когда единственным слабым электролитом в системе явл.вода.
Взаимная нейтрализация кислот и оснований различающихся по силе до конца не протекают,в силу протекания обратной реакции гидролиза образуются соли.
