Теория переходного состояния. Энергетические диаграммы для эндотермических и экзотермических реакций.
ТПС базируется на тех же принципах что и ТАС (теория активных соударений) с той лишь разницей, что взаимодействие происходит не мгновенно, а в течение какого-то промежутка времени, за который происходит перестройка хим-х связей.
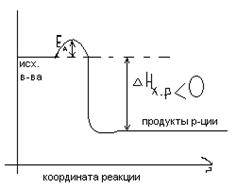
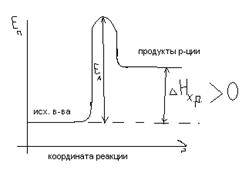
В ТПС энергия активации (EA) является энергетическим барьером, который система должна преодолеть, чтобы перейти от исх. в-в. к продуктам реакции. Путь системы при переходе от исх-х. в-в. к продуктам р-ции называется координатой р-ции.
Изменение потенциальной энергии системы(EП) при движении системы вдоль координаты реакции называется энергетической диаграммой.
Экзотермические р-ции: Эндотермические р-ции
Катализ. Гомогенный и гетерогенный катализ. Катализаторы и ингибиторы. Ферменты.
Катализ – процесс изменения скорости реакции под воздействием катализаторов. Различают гомогенный и гетерогенный катализ.
Гомогенный – катализатор и реагенты находятся в системе в одном и том же фазовом состоянии.
Гетерогенный – катализатор и реагенты находятся в разных фазовых состояниях и имеют границу раздела.
Катализаторы – вещества, которые ускоряют химические реакции, но при этом сами не расходуются.
Свойства: эффективность, селективность ( избирательность). Не влияют на термодинамику р-ции, тоесть не изменяют энтальпию и энергию Гиббса р-ции, а уменьшают энергию активации за счёт изм-я механизма реакции
Ингибиторы – вещества замедляющие нежелательные реакции. Ингибиторы не изменяют энергию активации, а изменяют продолжительность и последовательность превращений.
Химическое равновесие. Изменение концентрации реагирующих веществ и продуктов реакции с течением времени в обратимых реакциях.
Химическое равновесие – состояние, когда скорость прямой и обратной реакции равны.
ХР – это динамическое равновесие, тоесть скорости равны, одновременно протекают прямая и обратная реакции следовательно изменений в системе не заметно.
С течением времени по мере расходования продуктов р-ции их концентрации уменьшаются, следовательно скорость тоже уменьшается, а концентрация продуктов реакции увеличиваются. Одновременно в системе образуются продукты реакции которые могут разлагаться на исходные в-ва. При наступлении химического равновесия концентрации исходных в-в и продуктов р-ции перестают изменяться.
Константа равновесия и факторы ее определяющие. Связь константы равновесия с изменением энергии Гиббса химической реакции.
Константа равновесия – отношение произведения равновесных концентраций продуктов реакциик произведению равновесных концентраций исх-х. в-в. с учётом их стехеометрических коэффицентов.
КР – величина безразмерная, зависит от природы реагир-х в-в и температуры.
КР