Важнейшие классы неорганических соединений. Бинарные и многоэлементные соединения.
Основные понятия химии (атомная, молекулярная, молярная и эквивалентная масса, валентность).
Химия — наука, изучающая состав, строение, свойства, получение и превращения веществ.
Атомная масса (устаревшее название — атомный вес) — это значение массы атома, выраженное в атомных единицах массы
Молекулярная масса, сумма масс атомов, входящих в состав данной молекулы; выражается в атомных единицах массы (а.е. м.).
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
ЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента - это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
2 - Основные законы химии (сохранения массы, постоянства состава, простых кратных отношений, эквивалентов).
Закон сохранения массы по которому общая масса (вес) веществ, вступающих в реакцию, равна общей массе (весу) продуктов реакции.
Закон постоянства состава — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон кратных отношений — Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
3 - Газовые законы (Гей-Люссака. Бойля-Мариотта, Шарля, Менделеева-Клайперона). Идеальные и реальные газы.
Гей-Люссака законы, открытые Ж. Л. Гей-Люссаком в начале 19 в. законы, описывающие некоторые свойства газов.
1) Закон теплового расширения газов утверждает, что изменение объёма данной массы газа при постоянном давлении прямо пропорционально изменению температуры
(v2 — v1)/v1 = aDt
где v1 — объём газа при исходной температуре t1; v2 — при конечной t2; Dt = t2 — t1; a — коэффициент теплового расширения газов при постоянном давлении.
Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
В математической форме это утверждение записывается следующим образом
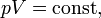
Закон шарля - 2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции.
Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
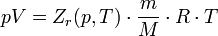
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с ихкинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц.
Реальный газ — газ, который не описывается уравнением состояния идеального газа
Химические свойства.
Кисло́ты — сложные вещества в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Классификация кислот
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3,H2SO4).
По основности — количество кислых атомов водорода
Одноосновные (HNO3);
Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
Трёхосновные (H3PO4, H3BO3).
Полиосновные (практически не встречаются).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH,CH3COOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3)
Способы получения
Бескислородные кислоты получают:
2. Действием на соль более сильной или менее летучей кислотой.
Кислородсодержащие кислоты получают:
1. Взаимодействием кислотных оксидов с водой.
2. Действием на соль более сильной кислотой.
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ.
Общие свойства кислот в водных растворах обусловлены присутствием катионов H+, которые образуются в процессе диссоциации кислот.
1. Растворы кислот изменяют окраску индикаторов.
2. Кислоты реагируют с основаниями, образуя соль и воду (реакция нейтрализации).
3. Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду.
4. Кислоты вступают в реакции обмена с солями согласно правилу: сильные кислоты вытесняют более слабые из их солей. При этом образуется новая соль и новая кислота.
5. При нагревании некоторые кислоты разлагаются, образуя кислотный оксид и воду.
Летучие кислоты: сероводородная (H2S), азотная (HNO3), соляная (HCl)
Неустойчивые кислоты: H2CO3, H2SO3.
Основные понятия химической термодинамики. Первый закон термодинамики.
Основные определения
Система – это тело или группа тел, которые находятся во взаимодействии
и условно обособлены от окружающей среды, в качестве которой рассматривается остальная часть вселенной.
Обмен энергией между системой и внешней средой может происходить
в виде теплоты и в виде работы. Работа может быть механической и немеханической (например, химической).
Системы подразделяют на гомогенные и гетерогенные.
Гомогенной называют систему, имеющую в каждом элементе объема одинаковые плотность и состав (например, раствор сахара в воде).
При наличии уравнений связи независимые составные части становятся взаимно зависимыми. Их называют компонентами. Число компонентов равно числу составных частей минус число уравнений связи.
Совокупность свойств системы называется ее состоянием.
Свойства, которые однозначно определяют состояние системы, называются термодинамическими параметрами. В свою очередь параметры делятся
на две группы. Параметры, зависящие от количества вещества, составляющего
систему, которые подчиняются закону аддитивности, называются экстенсивными. Параметры, которые не зависят от количества вещества и имеют одинаковые значения во всех точках системы, если она находится в равновесии называются интенсивным.
Процесс – это изменение состояния системы. Процесс может протекать в
равновесных условиях, когда при бесконечно малых воздействиях со стороны
внешней среды происходят бесконечно малые изменения параметров. Разновидностью равновесного процесса является обратимый процесс, совершив который, система возвращается в исходное состояние, не оставив изменений ни в системе, ни в окружающей среде.
Неравновесный (необратимый) процесс – это процесс, при котором изменения в системе происходят и при этом система не возвращается в исходное со-
стояние.
Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
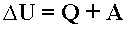
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
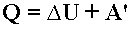
Энергетика растворения
Процесс растворения твердого вещества в воде сопровождается разрушением кристаллической решетки (затрата энергии в форме теплоты, -Qкр) и гидратацией – образованием гидратов B · nH2O, то есть соединений переменного состава между частицами растворенного вещества и молекулами воды (выделение теплоты, +Qгидр).
В результате общий тепловой эффект растворения равен
Q(р) = -Qкр + Qгидр
Если тепловой эффект растворения положительный (Q(р) больше 0), то после растворения вещества раствор становится теплее (например, это происходит в случае приготовления раствора AlCl3), если же тепловой эффект отрицательный (Q(р) меньше 0), то раствор становится холоднее (иногда температура может опуститься ниже 0 °С, например для NaNO3 или NH4NO3).
В тех редких случаях, когда Q(р) = 0, температура раствора остается постоянной
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Основные понятия химии (атомная, молекулярная, молярная и эквивалентная масса, валентность).
Химия — наука, изучающая состав, строение, свойства, получение и превращения веществ.
Атомная масса (устаревшее название — атомный вес) — это значение массы атома, выраженное в атомных единицах массы
Молекулярная масса, сумма масс атомов, входящих в состав данной молекулы; выражается в атомных единицах массы (а.е. м.).
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.
ЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента - это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
2 - Основные законы химии (сохранения массы, постоянства состава, простых кратных отношений, эквивалентов).
Закон сохранения массы по которому общая масса (вес) веществ, вступающих в реакцию, равна общей массе (весу) продуктов реакции.
Закон постоянства состава — любое определенное химически чистое соединение независимо от способа его получения состоит из одних и тех же химических элементов, причем отношения их масс постоянны, а относительные числа их атомов выражаются целыми числами.
Закон кратных отношений — Если один и тот же элемент образует несколько соединений с другим элементом, то на одну и ту же массовую часть первого элемента будут приходиться такие массовые части второго, которые относятся друг к другу как небольшие целые числа.
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
3 - Газовые законы (Гей-Люссака. Бойля-Мариотта, Шарля, Менделеева-Клайперона). Идеальные и реальные газы.
Гей-Люссака законы, открытые Ж. Л. Гей-Люссаком в начале 19 в. законы, описывающие некоторые свойства газов.
1) Закон теплового расширения газов утверждает, что изменение объёма данной массы газа при постоянном давлении прямо пропорционально изменению температуры
(v2 — v1)/v1 = aDt
где v1 — объём газа при исходной температуре t1; v2 — при конечной t2; Dt = t2 — t1; a — коэффициент теплового расширения газов при постоянном давлении.
Закон Бойля — Мариотта гласит:
При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно.
В математической форме это утверждение записывается следующим образом
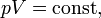
Закон шарля - 2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции.
Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
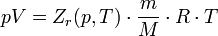
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М — молярная масса; R — газовая постоянная.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с ихкинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют также форму в виде упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц.
Реальный газ — газ, который не описывается уравнением состояния идеального газа
Важнейшие классы неорганических соединений. Бинарные и многоэлементные соединения.
К важнейшим классам неорганических веществ по традиции относят простые вещества (металлы и неметаллы), оксиды (кислотные, основные и амфотерные), гидроксиды (часть кислот, основания, амфотерные гидроксиды) и соли.
Бинарные соединения — химические вещества, образованные, как правило, двумя химическими элементами.
Большинство двухэлементных соединений (кроме основных, амфотерных и кислотных оксидов) и многоэлементных соединений (кроме гидроксидов и солей) часто относят к бинарным соединениям.
Многоэлементные вещества, в формульной единице которых одна из составляющих содержит не связанные между собой атомы нескольких элементов, а также одноэлементные или многоэлементные группы атомов (кроме гидроксидов и солей), рассматривают как бинарные соединения.
