Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся без разложения
Температуре плавления устойчивого химического соединения отвечает максимум на кривой ликвидуса – точка D– точка дистектики(рисунок2.30).
| I D II III IV V VI E VII |
| Tfus.B |
| Tfus.А |
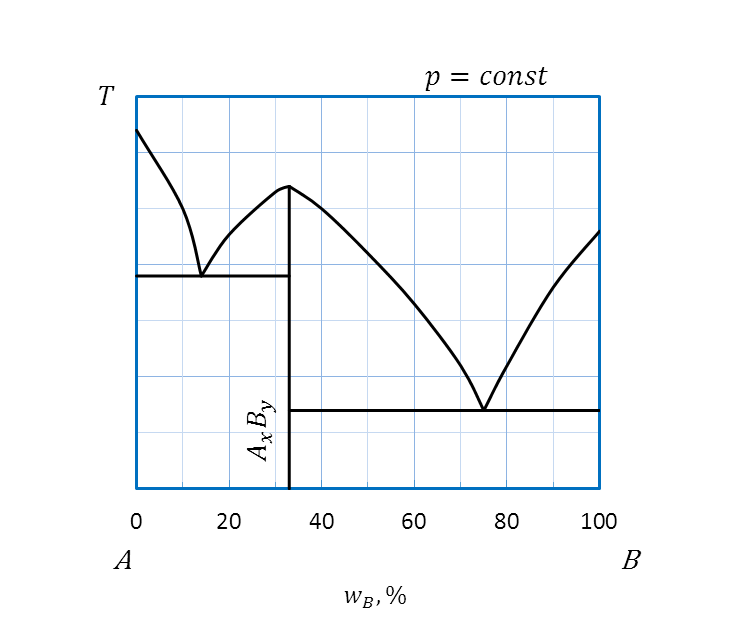
Области:
I –двухкомпонентный расплав A и B;
II – двухкомпонентный расплав A и B и кристаллы А;
III, IV – двухкомпонентный расплав A и B и кристаллы химического соединения АхВy;
V – двухкомпонентный расплав A и B и кристаллы B;
VI – кристаллы A и кристаллы химического соединения АхВy;
VII –кристаллы химического соединения АхВy и кристаллы В
Рисунок 2.30 – Диаграмма состояния А – B, компоненты которой
неограниченно растворимы в жидком состоянии и образуют между собой
в твердом состоянии химическое соединение, плавящееся конгруентно
Вертикаль, опущенная из точки D на ось состава, определяет состав химического соединения. Если A и B – металлы, то соединение АхВy называют интерметаллидом. Компоненты A и B сами могут быть химическими соединениямии, тем не менее, способными образовывать между собой в твердом агрегатном состоянии общее химической соединение, как, например, в системе CaCl2 – CsCl. Образующееся химическое соединение имеет формулу CaCl2.CsCl или в обобщенном виде CaCsCl3.
Анализ диаграмм с устойчивым химическим соединением удобнее проводить, если условно разделить диаграмму на две простых, например, диаграмма состояния компонента A (или B) и химического соединения (см. диаграммы с простой эвтектикой, раздел 2.2.3.4).
Диаграмма плавкости, компоненты которой образуют между собой в твердом состоянии химическое соединение, плавящееся с разложением
При образовании между компонентами A и B в твердом агрегатном состоянии химического соединения, плавящегося с разложением, на диаграммах на кривой ликвидуса отмечают наличие точки перитектики P. Эта температура примерно соответствует температуре плавления образующегося химического соединения АхВy. Составу соединения соответствует вертикальная линия постоянного состава (изоплета).
| I II P III IV V E VI |
| Tfus.B |
| Tfus.А |
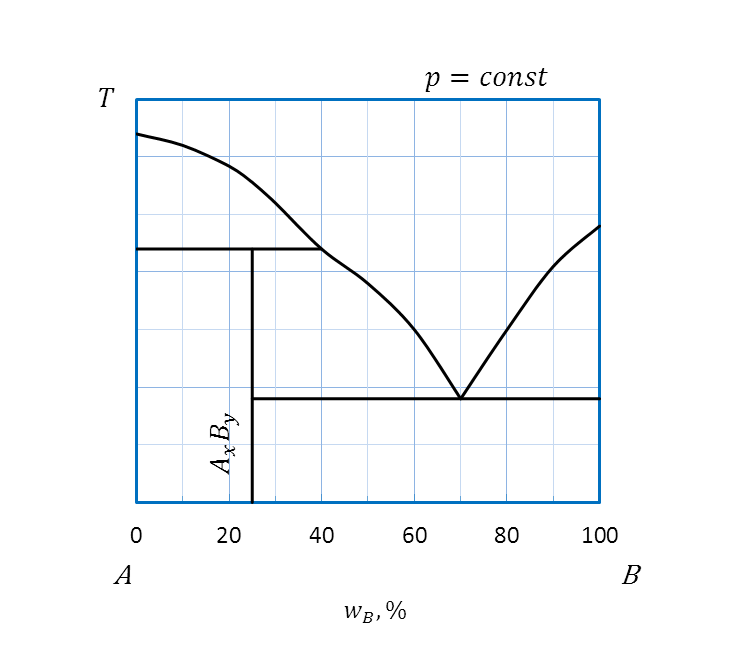
Области:
I –двухкомпонентный расплав A и B;
II – двухкомпонентный расплав A и B и кристаллы А;
III– двухкомпонентный расплав A и B и кристаллы химического соединения АхВy;
IV–двухкомпонентный расплав A и B и кристаллы B;
V – кристаллы A и кристаллы химического соединения АхВy;
VI –кристаллы химического соединения АхВy и кристаллы В.
Рисунок 2.31 – Диаграмма состояния А – B, компоненты которой
неограниченно растворимы в жидком состоянии и образуют между собой
в твердом состоянии химическое соединение, плавящееся инконгруентно
Все области диаграммы состояния (кроме области расплава I) являются гетерогенными, двухфазными. Для определения состава фаз в гетерогенной области условно следует провести ноду. Концы ноды показывают, какие из фаз находятся в равновесии друг с другом. Например, образующееся в твердом агрегатном состоянии химическое соединение находится в равновесии с кристаллами A – в области V, с расплавом – в области III, наконец, с кристаллами B – в области VI. В области IIхимическое соединение не существует, разлагается, вместо него в равновесии друг с другом находятся кристаллы Aи расплав.
Примеры анализа диаграмм состояния
Пример: Охарактеризуйте диаграмму плавкости системы Bi–Cd, приведенной на рисунке 2.32.
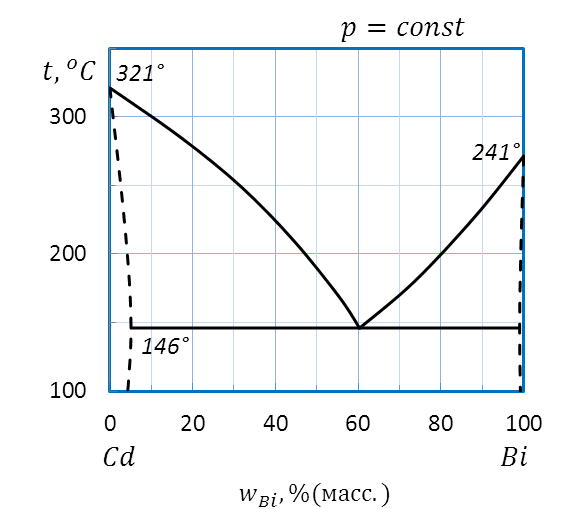
Рисунок 2.32 – Диаграмма состояния Bi – Cd
Решение:
Диаграмма плавкости системы Bi–Cd относится к диаграммам состояния с неограниченной растворимостью в жидком и ограниченной растворимостью компонентов в твердом агрегатных состояниях.
Пример: Дайте описание состояния системы Bi–Cd (рисунок 2.32) в различных условиях, расшифровав значение всех полей, линий и характерных точек диаграммы.
Решение:
По диаграмме плавкости Bi–Cd (рисунок 2.32) определяем температуры плавления чистых веществ: 321˚С для Cd и 241˚С для Bi, соответственно.
Точка E на диаграмме (рисунок 2.33) соответствует эвтектическому составу расплава. Прямая, проходящая через эту точку, называется линией эвтектики.
Кривая Tfus.,Cd–E–Tfus.,Bi– линия ликвидуса, показывает состав жидкой фазы.
Ломаная Tfus.,Cd–E’E’’–Tfus.,Biназывается линией солидуса, позволяет определить состав твердой фазы.
Выше линии ликвидуса в области I система является гомогенной или однофазной, это область существования жидкой фазы (расплава).
Ниже линии ликвидуса система гетерогенная, т.е. двухфазная. В области II сосуществуют расплав и твердый раствор Bi в Cd, в области III – расплав и твердый раствор Cd в Bi, в гомогенной области IV– твердый раствор Bi в Cd, в гомогенной области V – твердый раствор Cd в Bi. Ниже линии эвтектики в гетерогенной области VI сосуществуют оба твердых раствора совместно Cd в Bi и Bi в Cd
На линии эвтектики E’EE” в равновесии находятся сразу три фазы: два твердых раствора составовE’ иE’’ и расплав состава Е.
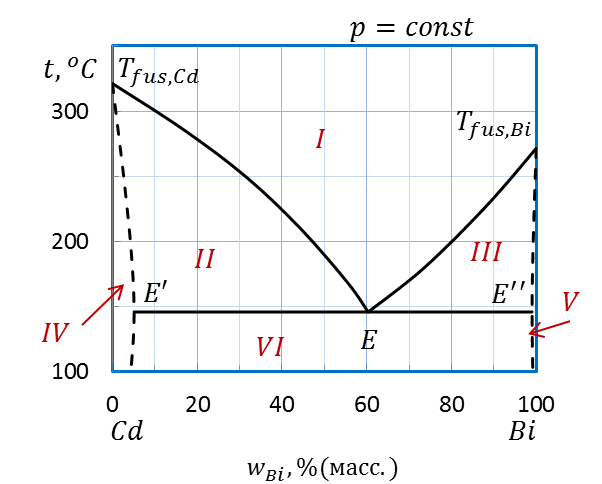
Области: I –расплава, II - расплав и твердый раствор Bi в Cd,
III – расплав и твердый раcтвор Cd в Bi, IV– твердый раствор Bi в Cd,
V – твердый раствор Cd в Bi, VI– твердые растворы Cd в Bi и Bi в Cd
Линии:Tfus.,Cd–E–Tfus.,Bi–линия ликвидуса, Tfus.,Cd–E’E’’–Tfus.,Bi– линия солидуса,
E’EE” –линия эвтектики
Рисунок 2.33 – Диаграмма состояния Bi – Cd
Пример: Определите температуру начала кристаллизации расплава I(30 % (масс.) Bi, 300˚С) системы Bi–Cd (рис.2.32) и состав первых кристаллов. Как изменяется состав расплава и твердой фазы при охлаждении?
Решение:
Опускаем перпендикуляр от точки I на ось состава(рис. 2.34). Прямая пересекает линию ликвидуса Tfus.,Cd–E–Tfus.,Bi при температуре 250˚С в точке a – температуре начала кристаллизации.
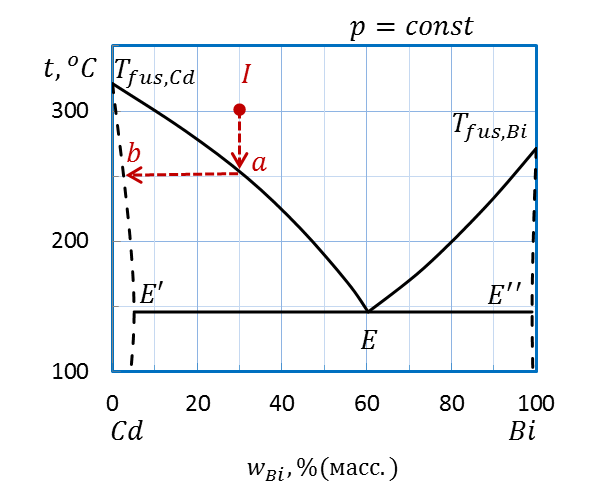
Рисунок 2.34 – Диаграмма состояния Bi – Cd.
Определение температуры начала кристаллизации расплава I
и состава первых кристаллов
Для определения состава первых кристаллов проводим при постоянной температуре внутри гетерогенной области ноду (линию, соединяющую фазы, находящиеся в равновесии) от линии пересечения кривой ликвидуса до линии солидуса Tfus.,Cd–E’E’’–Tfus.,Bi– точка b. Первые кристаллы – твердый раствор Bi в Cd состава примерно 2 масс.% Bi и 98 масс.% Cd.
При дальнейшем охлаждении (рисунок 2.35) от точки а до точки а’ в системе сосуществуют две фазы: расплав и твердый раствор Bi в Cd. Состав твердого раствора при понижении температуры меняется по кривой Tfus.,Cd–E’ отb(2 % (масс.) Bi) до точкиE’ (5 % (масс.) Bi), поскольку при какой бы температуре внутри этой области не проводили бы ноду, один конец ее упирается в линию солидусаTfus.,Cd–E’, ограничивающей область существования твердого раствора. Другой конец ноды оказывается на линии ликвидусаTfus.,Cd–E. Состав жидкой фазы при понижении температуры от точки a до точки a’ меняется от точки a (30 % (масс.) Bi) до точки E (60 % (масс.) Bi) по кривой ликвидуса.
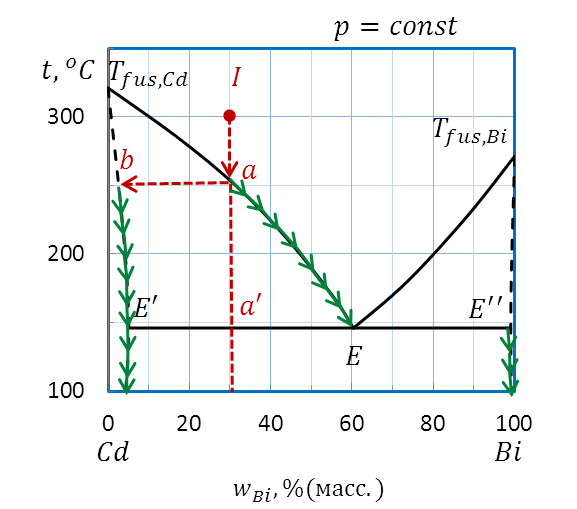
Рисунок 2.35 – Диаграмма состояния Bi – Cd.
Определение состава фаз при охлаждении расплава I
Таким образом, при кристаллизации жидкости исходного состава I меняется как состав твердой, так и жидкой фаз. В обеих фазах при понижении температуры увеличивается содержание Bi, количество твердого раствора увеличивается, количество расплава уменьшается.
По достижении линии эвтектики E’EE” из последних капелек расплава состава Е помимо твердого раствора состава E’ начинает кристаллизоваться еще один твердый раствор состава E” (примерно 98% (масс.) Bi). Температура системы остается постоянной, пока кристаллизация полностью не закончится.
Последующее понижение температуры свидетельствует об охлаждении гетерогенной системы, состоящей из смеси твердых растворов (рисунок 2.35: стрелки на диаграмме от точек E’ и E” вниз).
Пример: Определите температуру начала плавления, количество и состав фаз при этой температуре системы состава II(80 %(масс.) Bi, 100˚С) диаграммы плавкости Bi – Cd, приведенной на рисунке 2.32.
Решение:
Проводим перпендикуляр от точки II вверх (рисунок 2.36). Штриховая прямая пересекает линию эвтектики E’–E–E’’ при температуре 145˚С – температуре начала плавления.
При температуре эвтектики система состоит из трех фаз: точка E’ показывает состав одной твердой фазы – твердый раствор Bi в Cd (~ 5 % (масс.) Bi) , точка E’’ – состав другой твердой фазы – твердый раствор Cd в Bi (~ 98 % (масс.) Bi), наконец, точка E соответствует составу первых капель жидкой фазы – эвтектического расплава. Состав расплава – 60 % (масс.) Bi и 40 % (масс.) Cd.
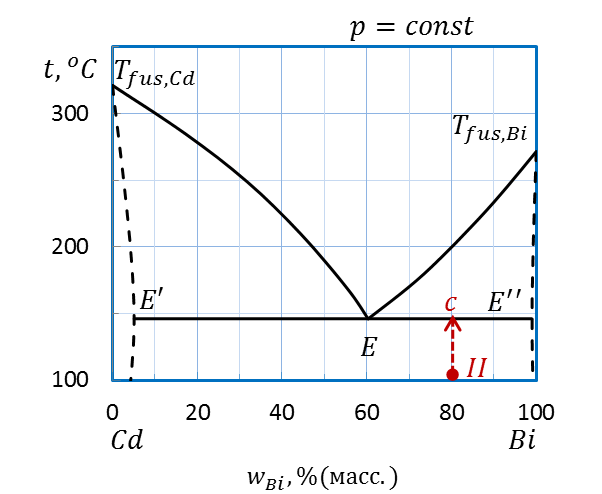
Рисунок 2.36 – Диаграмма состояния Bi – Cd.
Определение температуры начала плавления
Пример: Начертите схематические кривые охлаждения расплавов составов I (30 % (масс.) Bi), II (80 % (масс.) Bi) и III(100 % (масс.) Bi) диаграммы плавкости Bi – Cd (рисунок 2.32), определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривых охлаждения.
Решение:
Проводим перпендикуляр (или изоплету, т.е. линию постоянного состава, проходящую через несколько температур) от точки I (30 % (масс.) Bi) при температуре 300˚С вниз до оси состава. Штриховая прямая пересекает линию ликвидуса в точке а и линию эвтектики в точке a’, на оси состава ставим точку а”.
Рассчитываем число степеней свободы системы s по правилу фаз Гиббса для диаграммы состояния, построенной при постоянном давлении. Для расчета выделяем интервалы Ia, aa’, точку a’ и интервал a’a’’. Во всех случаях система является двухкомпонентной: Cd и Bi, т.е. k=2.
Ia: 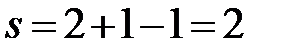 (f=1, одна жидкая фаза – двухкомпонентный расплав).
(f=1, одна жидкая фаза – двухкомпонентный расплав).
aa’: 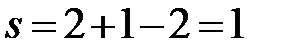 (f=2, сосуществуют две фазы – расплав и твердый раствор Bi в Cd).
(f=2, сосуществуют две фазы – расплав и твердый раствор Bi в Cd).
a’: 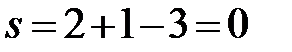 (f=3, в равновесии три фазы – расплав, твердый раствор Bi в Cd и твердый раствор Cd в Bi).
(f=3, в равновесии три фазы – расплав, твердый раствор Bi в Cd и твердый раствор Cd в Bi).
a’a’’: 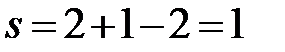 (f=2, сосуществуют две фазы – твердый раствор Bi в Cd и твердый раствор Cd в Bi).
(f=2, сосуществуют две фазы – твердый раствор Bi в Cd и твердый раствор Cd в Bi).
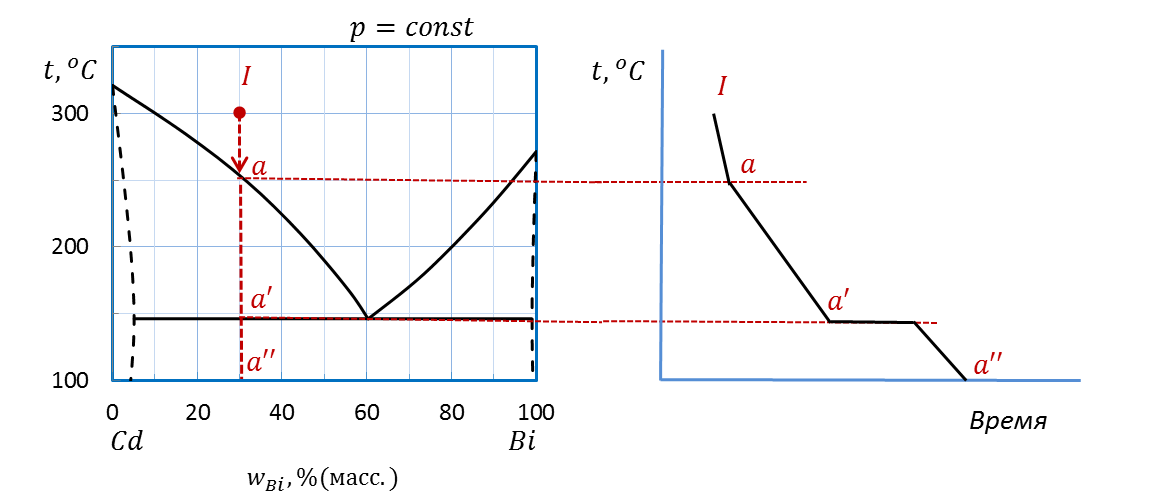
Рисунок 2.37 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава I
Переносим точки изменения числа фаз aи a’ на соседний график температура - время.
Чертим кривую охлаждения, учитывая, что падение температуры при охлаждении системы более резкое, если система бивариантна (s=2); более пологое вследствие выделения теплоты при кристаллизации, если система моновариантна(s=1). Наконец, температура остается постоянной для нонвариантной системы (s=0).
В случае II (рисунок 2.38) также проводим изоплету (или перпендикуляр) от температуры 300˚С вниз до оси состава. Штриховая прямая пересекает линию ликвидуса в точке b и линию эвтектики в точке b’, на оси состава ставим точку b”.
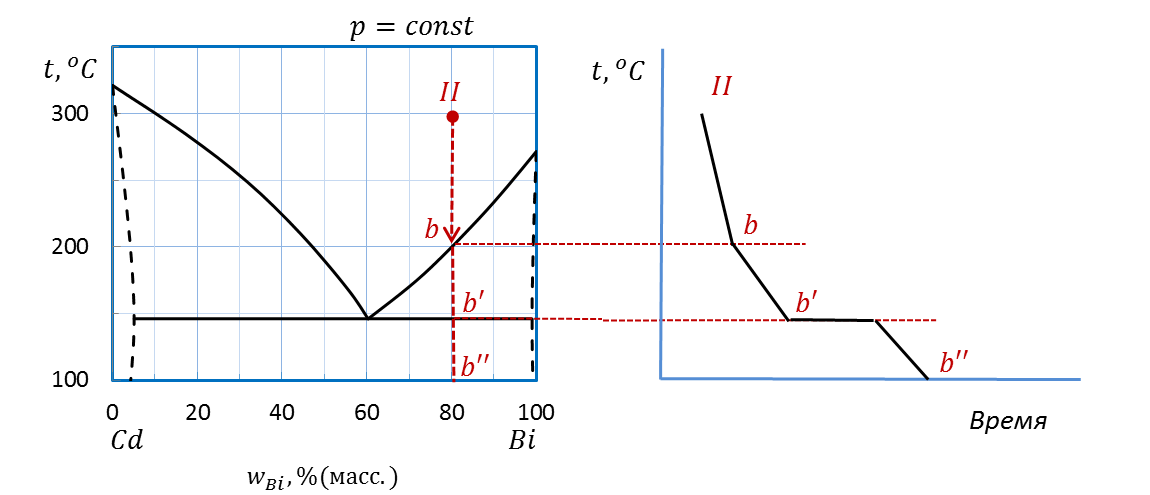
Рисунок 2.38 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава II
Для расчета выделяем интервалы IIb, bb’, точку b’ и интервал b’b’’. Во всех случаях система так же, как и в первом случае, является двухкомпонентной: Cd и Bi, т.е. k=2.
IIb: 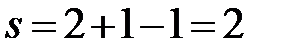 (f=1, одна жидкая фаза – двухкомпонентный расплав).
(f=1, одна жидкая фаза – двухкомпонентный расплав).
bb’: 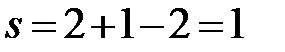 (f=2, сосуществуют две фазы – расплав и твердый раствор Cd в Bi).
(f=2, сосуществуют две фазы – расплав и твердый раствор Cd в Bi).
b’: 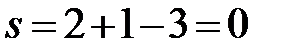 (f=3, в равновесии три фазы – расплав, твердый раствор Cd в Bi и твердый раствор Bi в Cd).
(f=3, в равновесии три фазы – расплав, твердый раствор Cd в Bi и твердый раствор Bi в Cd).
b’b’’: 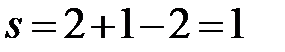 (f=2, сосуществуют две фазы – твердый раствор Cd в Bi и твердый раствор Bi в Cd).
(f=2, сосуществуют две фазы – твердый раствор Cd в Bi и твердый раствор Bi в Cd).
Сносим точки изменения числа фаз bи b’ на график температура-время.
Рисуем схематично кривую охлаждения аналогично примеру I.
В случае III (рисунок 2.39) проводим изоплету от температуры 300˚С до оси состава. Штриховая прямая пересекает температуру плавления Bi в точке c, на оси состава ставим точку c’.
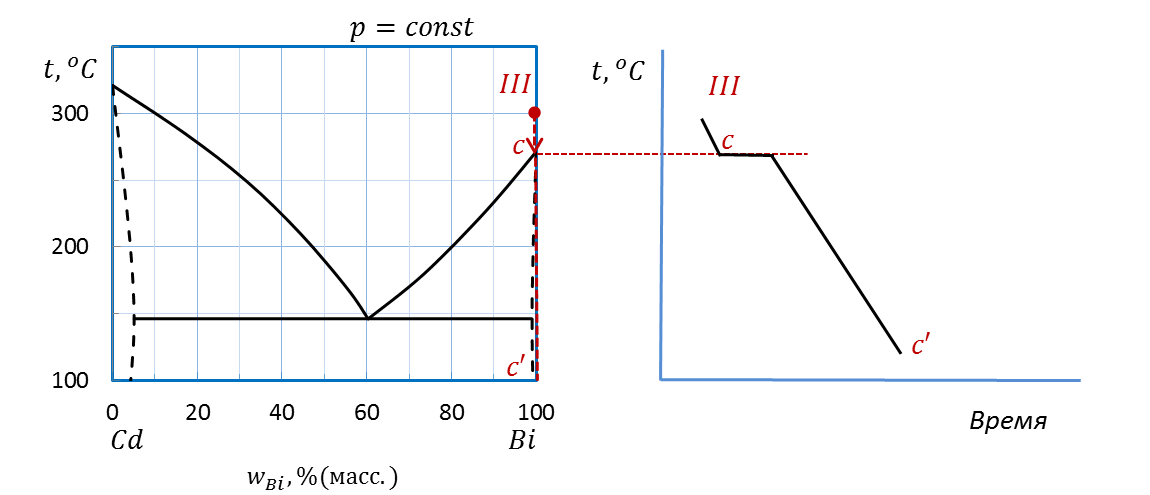
Рисунок 2.39 – Диаграмма состояния Bi – Cd.
Построение кривой охлаждения расплава III
Для расчета выделяем интервалы IIIc, точку c и интервал cc’. Во всех случаях система является однокомпонентной: один компонент Bi, т.е. k=1.
IIIc: 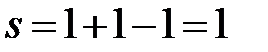 (f=1, одна жидкая фаза – жидкий Bi).
(f=1, одна жидкая фаза – жидкий Bi).
c: 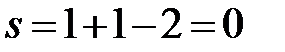 (f=2, в равновесии две фазы – жидкий и кристаллический Bi).
(f=2, в равновесии две фазы – жидкий и кристаллический Bi).
cc’: 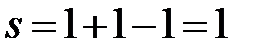 (f=1, одна твердая фаза – кристаллы Bi).
(f=1, одна твердая фаза – кристаллы Bi).
Переносим точку изменения числа фаз cна график температура–время.
Чертим кривую охлаждения аналогично случаям I и II.
Пример: Начертите схематическую кривую охлаждения расплава состава a (60 %B) диаграммы плавкости A–B (рисунок 2.26), определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривой охлаждения.
Решение:
Проводим изоплету (рисунок 2.40) от фигуративной точки d до оси состава. Штриховая прямая пересекает кривую ликвидуса в точке d’, кривую солидуса – в точке d’’, на оси состава ставим точку d’’’.
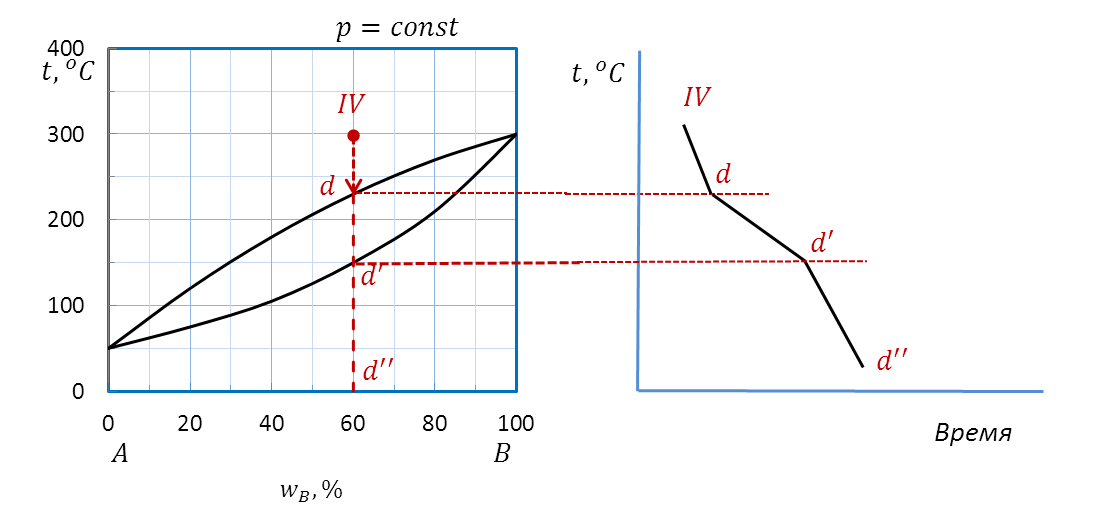
Рисунок 2.40 – Диаграмма состояния A – B.
Построение кривой охлаждения расплава IV.
Для расчета вариантности системы выделяем интервалы dd’, d’d’’ и интервал d’’d’’’. Во всех случаях система является двухкомпонентной, т.е. k=2.
dd’: 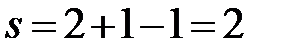 (f=1, одна жидкая фаза – расплав).
(f=1, одна жидкая фаза – расплав).
d’d’’: 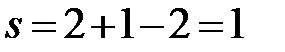 (f=2, в равновесии две фазы – расплав и твердый раствор A и B).
(f=2, в равновесии две фазы – расплав и твердый раствор A и B).
d’’d’’’: 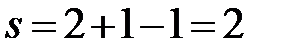 (f=1, одна твердая фаза – твердый раствор A и B).
(f=1, одна твердая фаза – твердый раствор A и B).
Переносим точки изменения числа фаз на график температура–время.
Чертим кривую охлаждения. На кривой охлаждения видны точки перегиба, соответствующие температурам начала (d’) и конца кристаллизации (d’’).
Пример: Вычислите массы равновесных фаз при температуре 200оС для 10 кг исходной смеси состава l(20 %(масс.)Bi) диаграммы плавкости Cd–Bi, приведенной на рисунке 2.32.
Решение:
Для вычисления масс фаз, находящихся в равновесии, при температуре 200оС проводим через состав l(20 %(масс.) Bi) ноду внутри гетерогенной области kn. Один конец ноды k показывает состав твердой фазы – примерно 4 % (масс.) Bi и 96 %(масс.) Cd, другой конец ноды n находится на кривой ликвидуса и позволяет определить состав сосуществующей жидкой фазы: 47 % (масс.) Bi и 53 % (масс.) Cd, соответственно.
Составляем правило рычага:
kl ∙ ms= ml∙ ln.
При подстановке вместо отрезков разности составов, выраженных, например, по %(масс.) Bi, получаем уравнение:
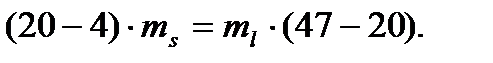 j
j
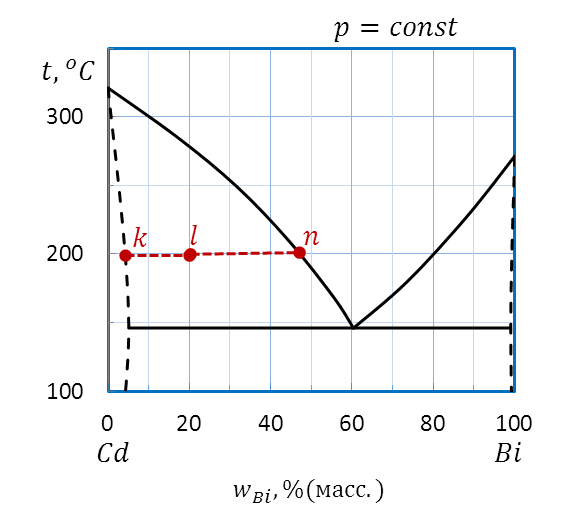
Рисунок 2.41 – Диаграмма состояния Bi – Cd.
Вычисление массы равновесных фаз системы состава lпо правилу рычага
Второе уравнение, необходимое для решения, связывает массы равновесных фаз и массу исходной смеси (10 кг):
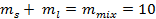 кг
кг
Решаем совместно оба уравнения. Результат:
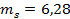 кг;
кг;
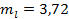 кг.
кг.
Пример: Определите формулу химического соединения, образующегося между компонентами системы Te–Al (рисунок 2.42) в твердом агрегатном состоянии.
Решение:
В системе Te–Al между компонентами в твердом агрегатном состоянии возможно образование химического соединения AlxTeyс температурой плавления 895оС.
Для определения х и y в формуле этого соединения пересчитываем состав по первому и второму компонентам, выраженный в %(масс.) (w), в % (ат.) или %(мол.) (x) по формулам:
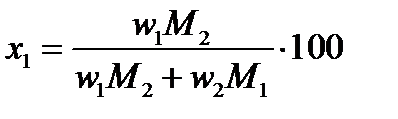 и и 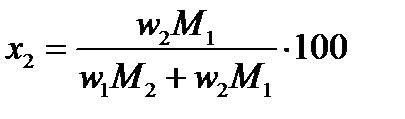 | (2.30) |
Для данной диаграммы wAl=12%(масс.), wTe=88%(масс.), MAl=26,98 г/моль,MTe=127,60 г/моль.
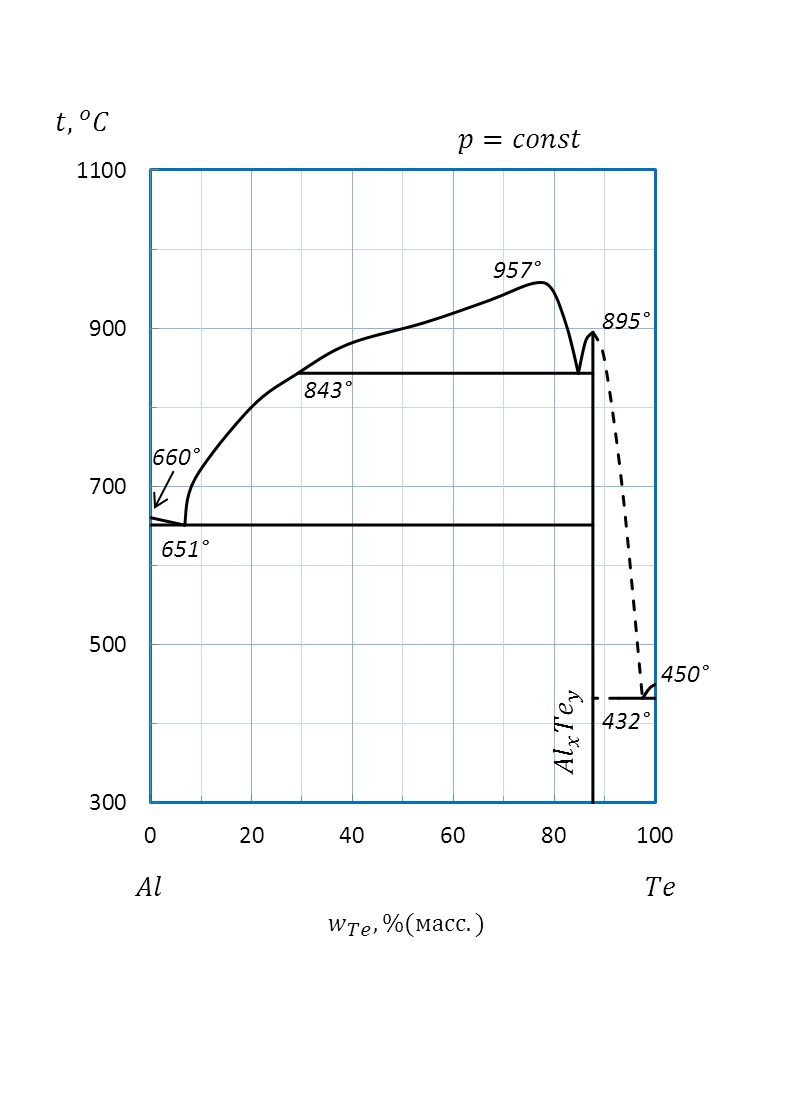
Рисунок 2.42 – Диаграмма состояния Te – Al.
Подстановка значений дает:
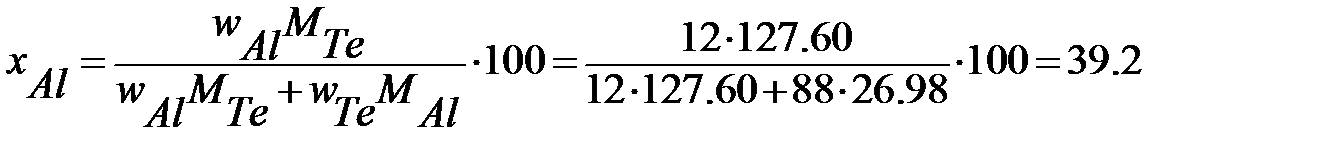 % (мол.) Al,
% (мол.) Al,
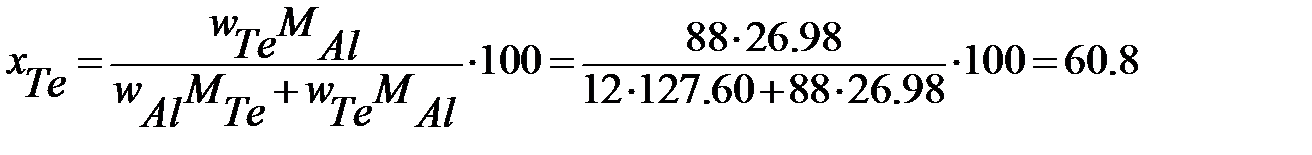 % (мол.) Te.
% (мол.) Te.
Отношение полученных составов, выраженных в % (ат.) или % (мол.), позволяет определить формулу химического соединения AlxTey:
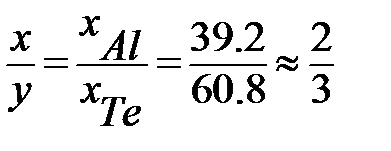 или Al2Te3 .
или Al2Te3 .
2.2.3.9 Многовариантное задание № 7 «Анализ диаграмм плавкости»
1. Охарактеризуйте диаграмму плавкости системы A – B (таблица 2.6): растворимость компонентов в жидких и твердых фазах, типы твердых растворов, наличие устойчивых и неустойчивых химических соединений.
2. Дайте описание состояния системы в различных условиях, расшифровав значение всех полей, линий и характерных точек диаграммы плавкости системы A – B (таблица 2.6).
3. Определите температуру начала кристаллизации расплава состава I и состав первых кристаллов. Как изменяется состав расплава и твердой фазы при охлаждении?
4. Определите температуру начала плавления, количество и состав фаз при этой температуре для системы состава II.
5. Начертите схематические кривые охлаждения расплавов состава I, II и III, определив число и состав фаз и рассчитав число степеней свободы в характерных точках и на каждом участке кривой охлаждения.
6. Вычислите массы равновесных фаз при заданной температуре t,оС и количестве исходной смеси состава III.
7. Для систем, образующих химические соединения, определите формулы этих соединений.
Таблица 2.6 – Варианты заданий
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| Mg – Cu | 500 г | ||||||
| Cr – Sn | 5 кг | ||||||
| Cd – Cu | 800 г | ||||||
| Cd – Hg | 4 кг | ||||||
| -75 | |||||||
| Sn – Ag | 300 г | ||||||
| Ca – Cu | 600 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| Zn – Mg | 700 г | ||||||
| Bi – Co | 2 кг | 99,995 | |||||
| 99,985 | |||||||
| Sb – Ag | 400 г | ||||||
| CuCl – LiCl | 2 моля | ||||||
| AgCl – LiCl | 300 г | ||||||
| Ag2SO4 - Na2SO4 | 400 г | ||||||
| MnSiO3 – CaSiO3 | 800 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| NaCl – LiCl | 0,5 моля | ||||||
| NaNO3 – NaNO2 | 500 г | ||||||
| TlCl – KCl | 800 г | ||||||
| PbCl2 – KCl | 500 г | ||||||
| PbBr2 – PbF2 | 300 г | ||||||
| TlCl – CuCl | 800 г | ||||||
| PbCl2 – PbF2 | 400 г | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| CuBr – KBr | 800 г | ||||||
| TlCl – AgCl | 0,2 моля | ||||||
| ВаCl2 – BaF2 | 300 г | ||||||
| CaAl2Si2O8 – 2NaAlSiO4 | 6 кг | ||||||
| TlNO2 – NaNO2 | 300 г | ||||||
| NaOH – NaF | 2 кг | ||||||
| CaMgSi2O6 – NaAlSi2O6 | 6 кг | ||||||
Продолжение таблицы 2.6
| Вар. | Система A-B | Количество исходной смеси | Подвариант | Составы исходной смеси по A,% | t, оС | ||
| I | II | III | |||||
| NaNO3 – KNO3 | 4 кг | ||||||
| FeI2 – CrI2 | 700 г | ||||||
| MgAl2O4– ZrO2 | 4 кг | ||||||
| Sn - Pb | 4 кг | ||||||
| Si – Ag | 700 г | < |
