Идеальные и неидеальные растворы
Растворомназывают гомогенную систему переменного состава, состоящую как минимум из двух компонентов. Различают газообразные, жидкие и твердые растворы. Растворы бывают с неограниченной и ограниченной растворимостью компонентов друг в друге.
При описании жидких растворов различают растворитель и растворенное вещество. Растворителем считают то вещество, которое в чистом виде находится в том же агрегатном состоянии, что и раствор. Если в чистом виде компоненты и раствор находятся в одинаковом агрегатном состоянии, то растворителем считают то вещество, которого больше. Обычно свойства растворителя обозначают подстрочным индексом «1», а растворенного вещества - индексом «2».
По характеру взаимодействия компонентов раствора различают идеальные и неидеальные растворы.
В идеальных растворах, состоящих из двух неограниченно растворимых друг в друге компонентов А и В, энергия взаимодействия двух различных частиц (ЕА-В) такая же, как и двух одинаковых (ЕА-А иЕВ-В):
ЕА-В =  (ЕА-А +ЕВ-В). (2.12)
(ЕА-А +ЕВ-В). (2.12)
Образование идеальных растворов происходит атермически (без теплового эффекта, теплота смешения ΔmixH= 0) и без изменения объема (ΔmixV= 0). Изменение энтропии при образовании идеальных растворов такое же, как при смешении идеальных газов:
ΔmixS= - R(xАlnxА + xВlnxВ). (2.13)
Идеальные жидкие растворы описываются законом Рауля:
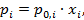 (2.14)
(2.14)
где 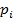 - парциальное давление насыщенного пара i-го компонента над раствором;
- парциальное давление насыщенного пара i-го компонента над раствором;
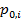 - давление насыщенного пара над чистым жидкимi-м компонентом;
- давление насыщенного пара над чистым жидкимi-м компонентом;
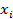 – молярная доля i-го компонента в растворе.
– молярная доля i-го компонента в растворе.
Для идеальных растворов закон Рауля выполняется для всех компонентов при всех температурах и концентрациях.
Химический потенциал компонента идеального раствора:
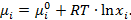 (2.15)
(2.15)
Идеальные растворы образуются из веществ, очень близких по своим свойствам (изотопы, оптические изомеры, гомологи).
В большинстве случаев при смешении жидких компонентов образуются неидеальные растворы. Большинство реальных растворов являются неидеальными. В таких растворах энергия взаимодействия разнородных частиц отличается от энергии взаимодействия одинаковых частиц:
ЕА-В 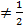 (ЕА-А +ЕВ-В). (2.16)
(ЕА-А +ЕВ-В). (2.16)
Образование неидеальных растворов сопровождается тепловым эффектом(ΔmixH 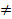 0) и/или изменением объема (ΔmixV
0) и/или изменением объема (ΔmixV 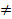 0). Изменение энтропии при смешении компонентов неидеальных растворов отличается от энтропии смешения идеальных газов (2.13).
0). Изменение энтропии при смешении компонентов неидеальных растворов отличается от энтропии смешения идеальных газов (2.13).
Для неидеальных растворов уравнение Рауля неприменимо ( 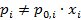 ). (Оно может быть применимо только по отношению к растворителю в очень разбавленных реальных растворах).
). (Оно может быть применимо только по отношению к растворителю в очень разбавленных реальных растворах).
Различают неидеальные растворы с положительными и отрицательными отклонениями от идеальности (от закона Рауля). При положительных отклоненияхот идеальности энергия взаимодействия разнородных частиц в растворе меньше энергии взаимодействия одинаковых частиц:
ЕА-В 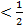 (ЕА-А +ЕВ-В). (2.17)
(ЕА-А +ЕВ-В). (2.17)
Такие растворы образуются, как правило, с поглощением тепла (ΔmixH 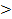 0) и с увеличением объема (ΔmixV
0) и с увеличением объема (ΔmixV 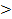 0).
0).
Для систем с положительными отклонениями от закона Рауля общее давление насыщенного пара над неидеальным раствором больше, чем над идеальным раствором p 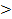 pид. Силы межчастичного взаимодействия между молекулами в растворе меньше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует меньших затрат энергий, чем перевод в пар компонентов идеального раствора.
pид. Силы межчастичного взаимодействия между молекулами в растворе меньше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует меньших затрат энергий, чем перевод в пар компонентов идеального раствора.
При отрицательных отклонениях от закона Рауляэнергия взаимодействия разнородных частиц в растворе больше энергии взаимодействия одинаковых частиц:
ЕА-В 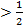 (ЕА-А +ЕВ-В),. (2.18)
(ЕА-А +ЕВ-В),. (2.18)
Образование такого раствора сопровождается выделением тепла (ΔmixH 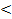 0) и уменьшением объема (ΔmixV
0) и уменьшением объема (ΔmixV 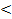 0).
0).
Для систем с отрицательными отклонениями от закона Рауля общее давление насыщенного пара над неидеальным раствором меньше, чем над идеальным раствором p 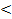 pид. Силы межчастичного взаимодействия между молекулами в растворе больше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует больших затрат энергий, чем перевод в пар компонентов идеального раствора.
pид. Силы межчастичного взаимодействия между молекулами в растворе больше, чем между молекулами чистых компонентов, и, следовательно, перевод компонентов такого раствора в пар требует больших затрат энергий, чем перевод в пар компонентов идеального раствора.
Для описания свойств неидеальных растворов вводят понятие активностиi-го компонента в растворе 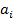 .
.
Активность компонента в растворе– это величина, прямо пропорциональная концентрации, которая используется вместо концентрации в уравнениях, выведенных для идеальных растворов, так чтобы эти уравнения выполнялись и для неидеальных растворов. Т.е.
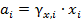 , (2.19)
, (2.19)
где 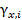 - коэффициент активности.
- коэффициент активности.
Коэффициент активностихарактеризует отклонение свойств компонента неидеального раствора от свойств компонента идеального раствора. Коэффициент активности зависит от концентрации компонента в растворе.
Значение и обозначение коэффициента активности зависит от того, в каких единицах выражается концентрация компонента. Если концентрация выражена в мольных долях, то коэффициент активности обозначается 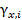 . Для молярной концентрации соответствующий коэффициент активности обозначается
. Для молярной концентрации соответствующий коэффициент активности обозначается 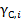 . Для моляльной концентрации коэффициент активности обозначается
. Для моляльной концентрации коэффициент активности обозначается 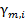 или
или 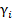 .
.
Химический потенциал компонента неидеального раствора выражается уравнением:
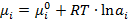 (2.20)
(2.20)
Для неидеального раствора используется уравнение, аналогичное закону Рауля:
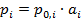 (2.21)
(2.21)
где 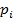 – давление насыщенного пара i-го компонента над неидеальным раствором (экспериментально определенное давление).
– давление насыщенного пара i-го компонента над неидеальным раствором (экспериментально определенное давление).
Пример: Вычислим по закону Рауля давление водяного пара над водным раствором C12H22O11 (m =1,101 моль/кг Н2О) при 75˚С. Давление насыщенного водяного пара над чистой водой при 75˚С p0,1 = 38,548 кПа. Рассчитаем активность и коэффициент активности воды, если экспериментально измеренное давление водяного пара над раствором p =37,954 кПа.
Решение:
Мольная доля воды 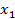 в растворе определяется как:
в растворе определяется как:
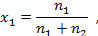
где 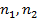 – количества молей растворителя и растворенного вещества, соответственно.
– количества молей растворителя и растворенного вещества, соответственно.
Поскольку моляльность раствора - это количество молей растворенного вещества в 1000 граммах растворителя, запишем 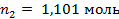 . Количество молей воды, находящихся в 1000 г, рассчитаем:
. Количество молей воды, находящихся в 1000 г, рассчитаем:
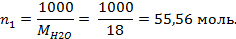
Отсюда
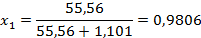
Давление водяного пара над водным раствором C12H22O11 рассчитаем по закону Рауля (2.14):
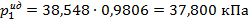 .
.
Можно видеть, что 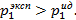 Следовательно, наблюдается положительное отклонение от закона Рауля.
Следовательно, наблюдается положительное отклонение от закона Рауля.
Рассчитаем активность воды из уравнения (2.21):
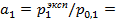 37,954/38,548 = 0,9846
37,954/38,548 = 0,9846
Найдем коэффициент активности воды по уравнению (2.19):
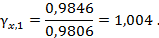
Для разбавленного водного раствораC12H22O11 наблюдаются незначительные положительные отклонения от идеальности.
Жидкие растворы обладают некоторыми свойствами, независящими от природы растворенного вещества, а определяющимися только числом частиц растворенного вещества в растворе. Такие свойства называются коллигативными. К таким свойствам относятся понижение температуры замерзания (или плавления) и повышение температуры кипения раствора по сравнению с чистым растворителем и осмотическое давление. Для идеальных растворов справедливы уравнения:
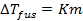 ,(2.22)
,(2.22)
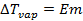 , (2.23)
, (2.23)
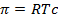 , (2.24)
, (2.24)
где 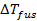 – понижение температуры замерзания (плавления) раствора по сравнению с температурой замерзания (плавления) растворителя;
– понижение температуры замерзания (плавления) раствора по сравнению с температурой замерзания (плавления) растворителя;
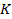 – криоскопическая постоянная, зависящая только от свойств растворителя;
– криоскопическая постоянная, зависящая только от свойств растворителя;
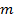 – моляльность раствора, моль/кг растворителя;
– моляльность раствора, моль/кг растворителя;
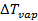 – повышение температуры кипения раствора по сравнению с температурой кипения растворителя;
– повышение температуры кипения раствора по сравнению с температурой кипения растворителя;
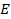 – эбулиоскопическая постоянная, зависящая только от свойств растворителя;
– эбулиоскопическая постоянная, зависящая только от свойств растворителя;
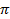 – осмотическое давление, Па;
– осмотическое давление, Па;
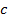 – молярная концентрация, моль/м3.
– молярная концентрация, моль/м3.
При диссоциации или ассоциации растворенного вещества число частиц в растворе изменяется. Это изменение можно учесть, введя в уравнения изотонический коэффициент Вант-Гоффа i. Тогда уравнения (2.22) – (2.24) запишутся в виде
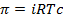 , (2.25)
, (2.25)
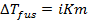 , (2.26)
, (2.26)
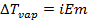 , (2.27)
, (2.27)
Изотонический коэффициентВант-Гоффа показывает, во сколько раз изменяется число частиц в растворе вследствие диссоциации или ассоциации молекул. В разбавленных растворах сильных электролитов величина этого коэффициента приближается к небольшим целочисленным значениям. Так, осмотическое давление (p) разбавленного раствора хлорида натрия с концентрацией с равно 2RTc (т.е.i=2). Это легко объяснялось тем, что концентрация частиц в растворе вдвое превышает величину концентрации, которая была рассчитана исходя из навески соли NaCl, растворенной в определенном объеме. Небольшие отклонения от целочисленных значений связывали с экспериментальными ошибками. Теперь в этом усматривают влияние коэффициентов активности.
Для слабых электролитов получили дробные значения i, зависящие от общей концентрации электролита. Используя теорию электролитической диссоциации Аррениуса можно установить связь между изотоническим коэффициентом Вант-Гоффа и степенью диссоциации a:
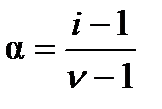 . (2.28)
. (2.28)
Определяя экспериментально осмотическое давление или понижение температуры замерзания раствора, можно вычислить коэффициент Вант-Гоффа i, а затем определить степень диссоциации a и рассчитать практическую константу диссоциации Кс для слабого электролита. Величину Кс также можно определить, используя кондуктометрический и потенциометрический методы. Рассчитанные разными методами Кс хорошо согласуются друг с другом, что служит убедительным доказательством справедливости электролитической теории Аррениуса для слабых электролитов.
Для сильных электролитов в разбавленных растворах степень диссоциации a 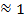 , т.е. число частиц должно увеличиться в nраз.Однако в действительности коэффициент Вант-Гоффа всегда меньше n, так как ионы в растворе связаны силами электростатического взаимодействия и не могут проявлять себя как вполне свободные частицы. Чем больше силы межионного взаимодействия, тем больше отклоняется данный реальный раствор от идеального раствора и тем меньше i.
, т.е. число частиц должно увеличиться в nраз.Однако в действительности коэффициент Вант-Гоффа всегда меньше n, так как ионы в растворе связаны силами электростатического взаимодействия и не могут проявлять себя как вполне свободные частицы. Чем больше силы межионного взаимодействия, тем больше отклоняется данный реальный раствор от идеального раствора и тем меньше i.
Пример: Определим, подчиняется ли идеальным законам раствор CaCl2 − H2O следующего состава: 0,944 г CaCl2 ,150 г H2O. Экспериментально определенное понижение температуры замерзания 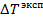 = 0,272 градуса.
= 0,272 градуса.
Решение:
Рассчитаем моляльность раствора:
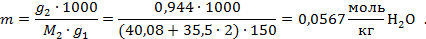
Найдем понижение температуры замерзания раствора, считая раствор идеальным, воспользовавшись справочными данными о криоскопической постоянной воды [2]:
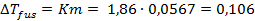 .
.
Сравнение рассчитанной величины 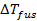 с экспериментальным значением
с экспериментальным значением 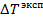 показывает, что данный раствор не является идеальным. В результате диссоциации молекул CaCl2 число частиц увеличивается.
показывает, что данный раствор не является идеальным. В результате диссоциации молекул CaCl2 число частиц увеличивается.
2.2.1.1 Многовариантное задание №4 «Определение активности и коэффициента активности растворителя в растворе»
1. Вычислите по закону Рауля давление насыщенного пара растворителя над раствором указанной концентрации (таблица 2.2).
2. Сравните с экспериментальным давлением pэксп.(таблица 2.2).
3. Объясните полученный результат.
4. Рассчитайте активность растворителя.
5. Рассчитайте коэффициент активности растворителя.
Таблица 2.2 – Варианты заданий
| Вар. | Состав раствора | t,˚С | p0,1, кПа | Подвариант | |||||||||||
| m, моль/кг H2O | pэксп., кПа | m, моль/кг H2O | pэксп., кПа | m, моль/кг H2O | pэксп., кПа | m, моль/кг H2O | pэксп., кПа | m, моль/кг H2O | pэксп., кПа | m, моль/кг H2O | pэксп., кПа | ||||
| H2SO4− H2O | 3,1672 | 0,100 | 3,1562 | 0,200 | 3,2370 | 0,300 | 3,1338 | 0,500 | 3,1105 | 0,700 | 3,0865 | 0,900 | 3,0609 | ||
| СaCl2− H2O | 7,3742 | 0,400 | 7,2191 | 0,800 | 7,0531 | 1,200 | 6,8235 | 1,600 | 6,5628 | 2,000 | 6,2946 | 2,400 | 5,9647 | ||
| NaI − H2O | 3,1672 | 0,500 | 3,1179 | 1,500 | 3,0046 | 2,000 | 2,9347 | 0,400 | 3,1282 | 1,200 | 3,4246 | 1,900 | 2,9735 | ||
| CО(NH2)2 − H2O | 3,1672 | 1,600 | 3,0818 | 3,200 | 3,0015 | 5,000 | 2,9248 | 1,000 | 3,1207 | 2,500 | 3,0044 | 4,500 | 2,9944 | ||
| C12H22O11 − H2O | 0,6104 | 1,651 | 0,5893 | 4,000 | 0,5508 | 6,000 | 0,5142 | 2,751 | 0,5723 | 5,000 | 0,5325 | 7,000 | 0,4978 | ||
| C12H22O11 − H2O | 1,2276 | 0,899 | 1,2052 | 1,600 | 1,1849 | 2,900 | 1,1430 | 1,100 | 1,1996 | 2,390 | 1,1600 | 2,500 | 1,2110 | ||
| C12H22O11 − H2O | 7,3742 | 0,700 | 7,2506 | 2,300 | 7,0776 | 4,200 | 6,9329 | 1,800 | 7,1198 | 3,000 | 7,0214 | 5,000 | 6,8825 | ||
| C12H22O11 − H2O | 12,333 | 0,402 | 12,252 | 1,000 | 12,128 | 2,390 | 11,853 | 0,850 | 12,160 | 2,200 | 11,887 | 3,571 | 11,636 | ||
| C12H22O11 − H2O | 19,915 | 0,852 | 19,701 | 1,748 | 19,482 | 2,390 | 19,302 | 1,573 | 19,528 | 2,050 | 19,402 | 2,650 | 19,226 | ||
| C12H22O11 − H2O | 31,152 | 0,800 | 30,752 | 1,573 | 30,418 | 2,448 | 30,056 | 0,500 | 30,898 | 1,000 | 30,669 | 1,700 | 30,360 | ||
| C12H22O11 − H2O | 47,335 | 0,600 | 46,931 | 1,300 | 46,496 | 2,000 | 46,093 | 1,000 | 46,681 | 1,500 | 46,375 | 2,200 | 45,989 | ||
| NH4Cl − H2O | 3,1672 | 0,500 | 3,1146 | 1,577 | 3,0099 | 3,000 | 2,8710 | 0,600 | 3,1045 | 1,300 | 3,0371 | 2,700 | 2,9007 | ||
| C12H22O11 − H2O | 47,335 | 0,400 | 47,128 | 1,252 | 46,562 | 2,300 | 45,927 | 1,100 | 46,747 | 1,573 | 46,348 | 2,390 | 45,882 | ||
| NaI − H2O | 3,1672 | 0,600 | 3,1086 | 1,300 | 3,0315 | 2,200 | 2,9060 | 0,700 | 2,9989 | 1,400 | 3,1775 | 2,100 | 2,9193 | ||
| NH4Cl − H2O | 3,1672 | 0,400 | 3,1245 | 1,700 | 2,9980 | 2,800 | 2,8906 | 0,700 | 3,0954 | 1,900 | 2,9784 | 3,200 | 2,8531 | ||
| NaI − H2O | 3,1672 | 1,100 | 3,0566 | 1,750 | 2,9704 | 3,000 | 2,7846 | 1,000 | 3,6685 | 1,600 | 2,9007 | 2,600 | 2,8455 | ||
| CО(NH2)2 − H2O | 3,1672 | 2,000 | 3,0619 | 4,000 | 2,9681 | 6,000 | 2,8834 | 1,300 | 3,1004 | 3,600 | 2,9982 | 5,500 | 2,9907 | ||
| KNO3− H2O | 2,3388 | 0,200 | 2,3243 | 0,500 | 2,3049 | 1,500 | 2,2528 | 2,000 | 2,2313 | 2,500 | 2,2125 | 3,000 | 2,1964 | ||
| HCl − H2O | 3,1672 | 0,050 | 3,1628 | 0,100 | 3,1577 | 0,200 | 3,1469 | 0,400 | 3,1239 | 0,600 | 3,1000 | 1,500 | 2,9710 | ||
| NaCl − H2O | 3,1672 | 0,100 | 3,1568 | 0,200 | 3,1464 | 0,400 | 3,1258 | 0,600 | 3,1051 | 0,800 | 3,0841 | 1,000 | 3,0627 | ||
| C12H22O11 − H2O | 31,152 | 1,101 | 30,619 | 1,965 | 30,256 | 2,750 | 29,940 | 2,200 | 30,157 | 2,600 | 30,000 | 3,000 | 29,845 | ||
| NH4Cl − H2O | 3,1672 | 0,900 | 3,0755 | 2,300 | 2,9396 | 4,000 | 2,7713 | 1,000 | 3,0661 | 2,500 | 2,9203 | 3,600 | 2,8148 | ||
| C12H22O11 − H2O | 47,335 | 1,100 | 46,612 | 1,850 | 46,181 | 3,000 | 45,553 | 2,500 | 45,826 | 2,700 | 45,717 | 2,900 | 45,609 | ||
| NaI − H2O | 3,1672 | 0,900 | 3,0790 | 1,650 | 2,9838 | 2,700 | 2,8302 | 2,300 | 2,8912 | 2,500 | 2,8607 | 2,900 | 2,7949 | ||
| NH4Cl − H2O | 3,1672 | 0,800 | 3,0852 | 2,100 | 2,9589 | 4,160 | 2,7553 | 1,400 | 3,0182 | 3,400 | 2,8342 | 3,800 | 2,7963 | ||
| СaCl2− H2O | 7,3742 | 0,200 | 7,2750 | 0,600 | 7,0924 | 1,000 | 6,9531 | 1,400 | 6,6937 | 1,800 | 6,4195 | 2,200 | 6,1334 |
2.2.1.2 Многовариантное задание № 5 «Коллигативные свойства растворов»
Определите, подчиняются ли идеальным законам указанные в таблице 2.3 растворы. Если не подчиняются − укажите причину.
Для систем:
ZnSO4 −H2O; H3BO3 − H2O; (C6H5O7)H3 − H2O;MgCl2 − H2O;
MgSO4 − H2O; CHCl2COOH− CCl4; CO(NH2)2 − NH3(ж)
приведено экспериментально определенное повышение температуры кипения, для всех других систем – понижение температуры замерзания ( 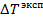 ).
).
Эбулиоскопические E и криоскопические K константы растворителей приведены в таблице 2.4.
Таблица 2.4 – Свойства растворителей
| Растворитель | H2O | C6H6 | CH3COOH | NH3(ж) | CCl4 |
| K | 1.86 | 5.07 | 3.6 | − | − |
| E | 0.513 | − | − | 0.33 | 5.64 |
| Таблица 2.3 – Варианты заданий | |||||||||||
| Вар. | Раствор | Подвариант | |||||||||
| Растворенное вещество | Раство- ритель | Масса растворенного вещества, г | Масса раство-рителя, г | 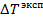 | Масса растворенного вещества, г | Масса раство-рителя, г | 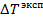 | Масса растворенного вещества, г | Масса раство-рителя, г | 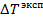 | |
| C2H5OН | H2O | 0,6206 | 0,248 | 2,3760 | 0,940 | 4,7800 | 1,92 | ||||
| CCl3COOH | H2O | 1,961 | 0,322 | 3,268 | 0,322 | 4,902 | 0,322 | ||||
| LiBr | H2O | 0,432 | 0,176 | 6,48 | 2,650 | 10,17 | 4,146 | ||||
| KCl | H2O | 1,508 | 0,675 | 5,14 | 2,298 | 2,96 | 1,323 | ||||
| CO(NH2)2 | NH3(ж) | 15,54 | 14,46 | 7,90 | 51,8 | 48,2 | 7,90 | 5,18 | 4,82 | 7,90 | |
| C6H5COOH | CH3COOH | 7,272 | 1,216 | 4,04 | 1,216 | 8,080 | 1,216 | ||||
| NaCl | H2O | 3,458 | 2,000 | 5,837 | 3,383 | 7,467 | 4,346 | ||||
| CCl3COOH | C6H6 | 2,611 | 0,350 | 1,632 | 0,350 | 4,080 | 0,350 | ||||
| H3BO3 | H2O | 2,54 | 0,214 | 3,81 | 0,214 | 6,35 | 0,214 | ||||
| CaCl2 | H2O | 0,558 | 0,244 | 0,629 | 0,272 | 0,909 | 0,388 | ||||
| MgCl2 | H2O | 5,055 | 0,416 | 3,37 | 0,416 | 4,381 | 0,416 | ||||
| NH4Cl | H2O | 0,0554 | 0,037 | 0,279 | 0,181 | 0,609 | 0,389 | ||||
| СН3ОН | H2O | 0,029 | 0,017 | 0,058 | 0,034 | 0,391 | 0,228 | ||||
| ZnSO4 | H2O | 0,104 | 0,00478 | 0,255 | 0,01059 | 0,525 | 0,0201 | ||||
| C6H12O6 | H2O | 0,357 | 0,036 | 2,388 | 0,248 | 3,601 | 0,372 | ||||
| KBr | H2O | 0,139 | 0,042 | 0,649 | 0,191 | 1,249 | 0,360 | ||||
| CHCl2COOH | CCl4 | 2,55 | 0,518 | 3,315 | 0,518 | 4,080 | 0,518 | ||||
| CH3COOС2H5 | H2O | 0,503 | 0,106 | 0,887 | 0,190 | 5,677 | 1,203 | ||||
| C3Н7OН | H2O | 0,302 | 0,094 | 1,220 | 0,372 | 5,500 | 1,590 | ||||
| Ba(NO3)2 | H2O | 0,0416 | 0,0084 | 0,091 | 0,018 | 0,227 | 0,043 | ||||
| C12H22O11 | H2O | 8,900 | 0,491 | 12,32 | 0,687 | 6,846 | 0,376 | ||||
| (C6H5O7)H3 | H2O | 8,86 | 0,256 | 17,84 | 0,525 | 1,135 | |||||
| MgSO4 | H2O | 0,0194 | 0,00137 | 0,0389 | 0,00256 | 0,0777 | 0,00488 | ||||
| SrCl2 | H2O | 3,175 | 0,961 | 5,992 | 2,532 | 4,010 | 1,350 | ||||
| NaNO3 | H2O | 0,181 | 0,063 | 0,409 | 0,140 | 0,905 | 0,300 | ||||
| KNO3 | H2O | 0,202 | 0,069 | 0,506 | 0,171 | 1,011 | 0,331 |
| Продолжение таблицы 2.3 | |||||||||||
| Вар. | Раствор | Подвариант | |||||||||
| Растворен-ное вещество | Раство- ритель | Масса растворенного вещества, г | Масса раство-рителя, г | 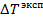 | Масса растворенного вещества, г | Масса раство-рителя, г | 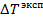 | Масса растворенного вещества, г | Масса раство-рителя, г | 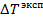 | |
| C2H5OН | H2O | 19,22 | 8,06 | 3,13 | 1,25 | 0,0452 | 0,018 | ||||
| CCl3COOH | H2O | 1,062 | 0,322 | 2,451 | 0,322 | 1,634 | 0,322 | ||||
| LiBr | H2O | 1,390 | 0,566 | 0,321 | 0,131 | 3,505 | 1,460 | ||||
| KCl | H2O | 2,237 | 1,000 | 0,991 | 0,444 | 0,619 | 0,277 | ||||
| CO(NH2)2 | H2O | 1,2017 | 0,369 | 1,802 | 0,552 | 2,434 | 0,369 | ||||
| C6H5COOH | C6H6 | 7,560 | 0,983 | 2,363 | 0,983 | 9,450 | 0,983 | ||||
| NaCl | H2O | 0,0996 | 0,058 | 0,606 | 0,360 | 1,093 | 0,641 | ||||
| CCl3COOH | C6H6 | 2,485 | 0,350 | 2,856 | 0,350 | 3,262 | 0,350 | ||||
| H3BO3 | H2O | 4,445 | 0,214 | 5,08 | 0,214 | 2,032 | 0,214 | ||||
| CaCl2 | H2O | 4,195 | 1,865 | 1,083 | 0,467 | 5,635 | 2,605 | ||||
| MgCl2 | H2O | 6,199 | 0,85 | 2,696 | 0,416 | 6,74 | 0,416 | ||||
| NH4Cl | H2O | 2,461 | 1,528 | 5,153 | 3,174 | 6,194 | 3,822 | ||||
| СН3ОН | H2O | 1,580 | 0,925 | 3,330 | 1,950 | 19,93 | 12,055 | ||||
| ZnSO4 | H2O | 1,03 | 0,0364 | 2,59 | 0,081 | 4,85 | 0,137 | ||||
| C6H12O6 | H2O | 5,503 | 0,599 | 7,342 | 0,772 | 19,86 | 2,117 | ||||
| KBr | H2O | 4,024 | 1,133 | 14,38 | 3,952 | 23,49 | 6,534 | ||||
| CHCl2COOH | CCl4 | 5,610 | 0,518 | 7,230 | 283,5 | 0,518 | 8,190 | 321,6 | 0,518 | ||
| CH3COOС2H5 | H2O | 7,008 | 1,510 | 8,504 | 1,820 | 10,58 | 2,224 | ||||
| C3Н7OН | H2O | 6,547 | 1,953 | 8,890 | 2,600 | 34,47 | 9,698 | ||||
| Ba(NO3)2 | H2O | 0,473 | 0,087 | 1,006 | 0,175 | 2,201 | 0,357 | ||||
| C12H22O11 | H2O | 10,27 | 0,569 | 14,500 | 0,815 | 3,596 | 0,196 | ||||
| (C6H5O7)H3 | H2O | 13,29 | 0,256 | 15,948 | 0,256 | 6,645 | 0,256 | ||||
| MgSO4 | H2O | 0,19 | 0,01097 | 0,392 | 0,021 | 0,777 | 0,0385 | ||||
| SrCl2 | H2O | 0,1587 | 0,051 | 0,792 | 0,245 | 1,585 | 0,483 | ||||
| NaNO3 | H2O | 1,304 | 0,423 | 2,366 | 0,732 | 3,490 | 1,088 | ||||
| KNO3 | H2O | 2,022 | 0,671 | 3,033 | 0,914 | 5,055 | 1,441 |
