Идеальные и неидеальные растворы. Коллигативные св-ва растворов.
Идеальные растворы –смеси, процесс образования которых не сопровождается тепловыми или объемными эффектами, т е ∆Н=0 и ∆V=0. Св-ва идеальных растворов не зависят от природы расвторенного вещества, а определяются лишь его концентрацией.
Коллигативные св-ва раствора – это те св-ва растворов которые зависят только от концентрации (т е не зависят от природы раств в-ва) π, ∆р, ∆Тзамерз, ∆Ткипи т.д.
Растворы, имеющие равные осмтические давления называют изотоническими.
Билет 27.
1. Основные положения электронной теории валентности Косселя-Льюиса. Ионный и ковалентный характер связи. Формулы Льюиса.
В 1916г Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам; эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же году Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны; при этом первый атом превращается в положительно, а второй – в отрицательно заряженный ион; взаимное электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений о ионной связи.
В зависимости от типов атомов образующих химическую связь, выделяют типы хим.связи:
1)ковалентная
2)ионная
3)металлическая и.д.р
Ковалентная связь- хим. связь между двумя атомами, осуществляемая общей для этих атомов парой электронов.
а) ковалентная неполярная- неметалл + неметалл; разность электроотрицательностей = 0; б)ковалентная полярная - неметал+неметал разность электроотрицательностей от 0-1.7
Для кванто-механического описания ковалентности связи и строения молекул могут быть применены 2 подхода : 1)метод валентных связей 2) метод молекулярных орбиталей. В основе метода валентных связей лежит следующие положения: 1)ковалентная хим.связь образуется двумя электронами, обладающими противоположно-направленными спинами и принадлежащими двум атомам, между которыми осуществляется связь. Такая общая электронная пара может образоваться как в результате спаривания двух не спаренных электронов, принадлежащих разным атомам (обычный механизм образования связи ), так и за счёт пары эл. одного атома- донора и вакантной орбитали второго атома-акцептора (донорно-акцепторный механизм образования связи); 2)ковалентная связь тем прочнее чем в большей степени перекрываются взаимодействующие эл. облака, поэтому ковалентная связь образуется в том направлении, где облака перекрываются максимально.
Исходные положения метода МО: 1)вся молекула рассматривается как единое целое, состоящее из ядер (бывших атомов) и электронов (ранее принадлежавших атому); 2)все эл. являются общими для всех ядер, то есть хим.связи являются многоцентровыми и каждая связь простирается между всеми ядрами в той или иной степени. Таким образом с точки зрения метода МО двух центровая связь представляет собой частный случай многоцентровой хим.связи. 3) Состояние эл. в молекуле описывается с решением соответствуешего уровнения Шреденгера для молекулярной системы.
Ионная связь- результат электростатического взаимодействия протонов, заряженных ионов обладающих обособленностью друг от друга электростатическими оболочками. Для оценки способности атома данного элем. оттягивать к себе общую эл. плотность пользуются величиной относительной электроотрицательности. Чем больше эл.отрицательность атома тем сильнее притягивает он общую эл. пару. Чем больше металлические свойства тем меньше эл.отрицательность. Чем больше неметаллические свойства тем выше эл.отрицательность. С ростом разности эл.отрицательности степень ионности связи возрастает. Свойства ковалентной связи.1)ковалентная связь насыщенная, это значит что между атомами ограниченное число связей; 2)Связь направлена по оси ох, оу, оz; 3)Связь поляризуемая - деформируется во внешнем эл.поле.
Свойства ионной связи 1)Ионная связь ненаправленная так как эл.поле иона во всех направлениях; 2)Ионная связь ненасыщенная - вещества с ионной кристаллической решеткой – твёрдые.
Формулы Льюиса: H-Cl электроот. Н=2.1, Сl= 3, ∆Е= 3-2.1=0.9 => связь ковалентная полярная. ∆Е > 2.1 (или 1.7) – ионный характер связи, 2.1(или 1.7)>∆Е>0 – коавлентная полярная связь, ∆Е = 0 - ковалентная неполярная связь.
2. Явление катализа. Гетерогенный катализ. Основные стадии гетерогенного катализа.
Катализаторы – в-ва, ускор. хим. реакции. Катализаторы действуют избирательно на каждую реакцию, т.е. подбирая соотв. катализатор можно направить процесс по желаемому пути. Катализаторы в конечном итоге не расходуются. А + В АВ(медленно). Образование промежуточного соединения ( А + К АК ; АК + В АВ + К) – быстрее, чем без катализатора.Катализаторы снижают энерг. барьер, кот. нужно преодолеть для прохождения данной реакции. Чем ниже энерг. барьер, тем выше Vреакц т.к больше молекул способны его преодолеть. Катализаторы не влияют на тепловой эффект процесса. Катализ бывает гомогенный или гетерогенный. В первом случае катализатор находится в одной фазе с реагирующими веществамивами 2СО(Г) + О2(Г) ( Н2О(Г))2СО2(Г) – гомогенный катализ. Во 2-м случае катализатор образует самостоятельную фазу 2H2O2(Ж) (Pt(К))2H2O(Ж) + O2(Г) – гетерогенный катализ.
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определенным запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными.
По Аррениусу константа скорости k и энергия активации Ea связаны соотношением, получившим название уравнения Аррениуса: k=Ze-Ea\RT Здесь Z – число столкновений, R – универсальная газовая постоянная, T – абсолютная температура. Таким образом, при постоянной температуре скорость реакции определяет Ea. Чем больше Ea, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении Ea скорость возрастает, а при Ea = 0 реакция протекает мгновенно. Затрачиваемая на перевод начальных продуктов в активное состояние энергия затем полностью или частично вновь выделяется при переходе к конечным продуктам. Разность энергий начальных и конечных продуктов определяет ΔH реакции, которая от энергии активации не зависит. Таким образом, по пути из исходного состояния в конечное система должна преодолеть энергетический барьер. Только активные молекулы, обладающие в момент столкновения необходимым избытком энергии, равным Ea, могут преодолеть этот барьер и вступить в химическое взаимодействие. С ростом температуры увеличивается доля активных молекул в реакционнной среде.
Изменить величину Ea можно с помощью катализаторов. Вещества, принимающие участие, но не расходующиеся в процессе реакции, назваются катализаторами. Само это явление называется катализом. В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. Механизм каталитического действия для них не одинаков, однако, и в том и в другом случае происходит ускорение реакции за счет снижения Ea, т. е. образуются частицы промежуточного соединения AK (катализатора с реагентами), затем активный комплекс AKB и конечные продукты с регенерацией катализатора. Следовательно, каталитический путь оказывается кинетически более выгодным, чем прямое взаимодействие исходных веществ. Существует ряд специфических катализаторов – ингибиторов, снижающих скорость реакции.
3. Сольволиз и гидролиз. Гидролиз солей. Степень и константа гидролиза.
Гидролиз солей - это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды. Это обратимая реакция нейтрилизации.
- Если соли образованы катионом сильного основания и анионом сильной кислотой
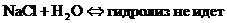
- Если соли образованы катионом сильного основания и анионом слабой кислотой
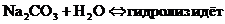
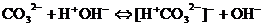 гидролиз идёт по слабому аниону, который забирает себе ион водорода. Среда щелочная, так как концентрация ионов гидроксила превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
гидролиз идёт по слабому аниону, который забирает себе ион водорода. Среда щелочная, так как концентрация ионов гидроксила превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
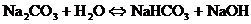
- Если соли образованы катионом слабого основания и анионом сильной кислотой
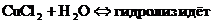
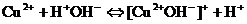 гидролиз идёт по слабому катиону, который забирает себе ион гидроксила. Среда кислая, так как концентрация ионов водорода превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
гидролиз идёт по слабому катиону, который забирает себе ион гидроксила. Среда кислая, так как концентрация ионов водорода превышена. Теперь дополняем уравнение гидролиза теми ионами, которые в нём не участвовали:
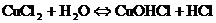
- Если соли образованы катионами слабого основания и анионами слабой кислоты 
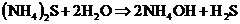 гидролиз идёт ДО КОНЦА, реакция НЕОБРАТИМА
гидролиз идёт ДО КОНЦА, реакция НЕОБРАТИМА
Степень гидролиза - это отношение числа молекул, подвергшихся гидролизу 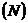 к общему числу молекул в растворе
к общему числу молекул в растворе 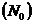 :
:
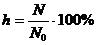
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесие процесса гидролиза.
- Если соль образована кислотой то 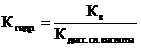
- Если соль образована слабым основанием то 
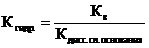
- Если соль образована слабой кислотой и слабым основанием то 
Билет 29.
