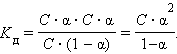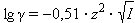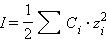Константа диссоциации. Закон разведения Оствальда. Ступенчатая диссоциация. Закон Дебая-Хюккеля.
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактеризовать константой диссоциации (ионизации), определяемой законом действующих масс.
Закон действующих масс, строго говоря, применим к обратимым реакциям, т. е. к растворам слабых электролитов. Так, например, диссоциацию электролита KtnAnm можно представить в виде равновесного процесса:
Ktn Anm -> nKtm+ + mAn- .
Константа равновесия Kc этой реакции и есть Kд:
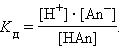 |
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим
|
Это соотношение называют законом разбавленияОствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
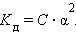 |
Тогда
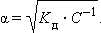 |
где (Ktm+) и (Ann- ) – молярные равновесные концентрации ионов электролита;
(KtnAnm) – молярная равновесная концентрация недиссоциированных молекул электролита;
КД – константа равновесия, называемая константой диссоциации.
Данное уравнение справедливо лишь для разбавленных растворов слабых электролитов.
Чем больше константа диссоциации КД , тем сильнее диссоциирует электролит. В отличие от степени диссо–циации КД зависит только от природы растворителя, электролита и температуры, но не зависит от концент–рации раствора.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например, диссоциация фосфорной кислоты происходит в три ступени:
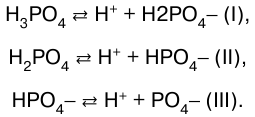
Каждая ступень диссоциации характеризуется своей константой.
Ступенчатая диссоциация характеризуется тем, что распад электролита на каждой последующей ступени происходит в меньшей степени, чем на предыдущей. Такой характер изменения констант диссоциации мож–но объяснить электростатическим притяжением на ос–нове закона Кулона. Энергия ионизации минимальна, когда ион отрывается от нейтральной молекулы элек–тролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, так как удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше.
Принципиальное отличие сильных электролитов от слабых состоит в том, что равновесие диссоциации сильных электролитов полностью смещено вправо:
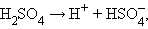 |
а потому константа равновесия (диссоциации) оказывается величиной неопределенной. Снижение электропроводности при увеличении концентрации сильного электролита обусловлено электростатическим взаимодействием ионов.
Дебай и Хюккель, предложив модель, которая легла в основу теории сильных электролитов, постулировали:
- Электролит полностью диссоциирует, но в сравнительно разбавленных растворах (C = 0,01 моль·л–1).
- Каждый ион окружен оболочкой из ионов противоположного знака. В свою очередь, каждый из этих ионов сольватирован. Это окружение называется ионной атмосферой.
Очевидно, что при электростатическом взаимодействии ионов противоположных знаков необходимо учитывать влияние ионной атмосферы. В этих системах само понятие концентрации становится неоднозначиным и должно заменяться активностью. Для бинарного однооднозарядного электролита KatAn → Kat+ + An+ активности катиона (a+) и аниона (a–) соответственно равны
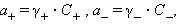 |
где C+ и C– – аналитические концентрации соответственно катиона и аниона, γ+ и γ– – их коэффициенты активности.
Определить активности каждого иона в отдельности невозможно, поэтому для одно-однозарядных электролитов пользуются средними геометрическими значений активностей и коэффициентов активностей:
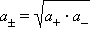 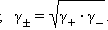 |
Коэффициент активности по Дебаю–Хюккелю зависит по крайней мере от температуры, диэлектрической проницаемости растворителя (ε) и ионной силы (I); последняя служит мерой интенсивности электрического поля, создаваемого ионами в растворе.
Для данного электролита ионная сила выражается уравнением Дебая–Хюккеля:
|
Ионная сила в свою очередь равна
|
34. Кислотно-основные реакции. Основные положения теории кислот и оснований. Приведите примеры расчетов pH растворов органических кислот и оснований.
Теория Аррениуса
Согласно теории Аррениуса, кислота - это электролит, диссоциирующий в растворе с образованием катионов водорода; основание - это электролит, диссоциирующий в растворе с образованием гидроксид-ионов; амфолит - это электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид-ионов.
Аммиак не содержит гидроксид-ион, но проявляет свойства основания. Углекислый газ не содержит ион водорода, но проявляет в растворах кислотные свойства. Теория Аррениуса имеет ряд ограничений. Она объясняет кислотно-основные свойства молекулы, но не может объяснить кислотно-основные свойства заряженных частиц - ионов.