Сильные и слабые электролиты. Концентрация ионов в растворе. Активность электролитов и ионов. Ионная сила растворов электролитов.
Электролиты-проводники, прохождение через которых электрического тока вызывает перемещение вещества в виде ионов и химические превращения.
Электролитическая диссоциация относится к обратимым процессам, поэтому в растворах электролитов наряду с распадом соединений на ионы имеет место и обратный процесс – их соединение.
Степень диссоциации (α) – это отношение числа продиссоциировавших (распавшихся) на ионы молекул (n) к общему числу растворенных молекул (N):
n
α = —
N
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе.
Поэтому в уравнениях диссоциации сильных электролитов ставят знак равенства (=).
К сильным электролитам относятся:
- растворимые соли;
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;
- основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄).
К слабым электролитам относятся:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др.
Неэлектролиты
Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
Электрический ток не проводят газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Степень диссоциации. Константа диссоциации
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам), например:
| c H2SO4 | 2c c 2H+ + SO42- |
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
α = n / N
и выражается в долях единицы или в % (α = 0,3 – условная граница деления на сильные и слабые электролиты).
Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении водой степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя (H2O) на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. гидратированных ионов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации и исходную концентрацию вещества c в растворе.
Активность электролитов
Переносчиками электрического тока в растворах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент Вант-Гоффа i, например:
Росм. = iCRT или 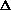 Tзам. = iKm.
Tзам. = iKm.
Изотонический коэффициент связан со степенью диссоциации электролита:
i = 1 + (n - 1),
где n - количество ионов, образующихся при диссоциации одной молекулы.
Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
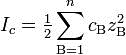
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде: 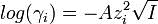 где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть активность ионов при концентрации 1 моль/л, называется коэффициентом активности: 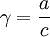
27. Автопротолиз воды и ионное произведение воды. Водородный показатель рН. Константы кислотности (Кa) и основности (Кb) как характеристика силы кислот оснований. Примеры.(билет 25)
Поведение слабых кислот и оснований в водных растворах. Расчет рН и равновесных концентраций частиц в этих растворах. Примеры.(все это есть в 25 билете)
Слабые одноосновные кислоты(НА) диссоциируют в водных растворах частично
и при этом устанавливается динамическое химическое равновесие:
НА ↔ Н++ А-
которое характеризуется соответствующей константой равновесия –константой кислотной диссоциации Kа=[H ] + [A ] - /[HA]
Константа кислотной диссоциации Kа(или еѐ показатель pKa= -lgKa) характеризует силу кислоты –чем меньше значение K(больше pKa), тем слабее кислота, и наоборот.
Например, уксусная кислота (K= 1,74∙10-5, рa= 4,76) слабее, чем муравьиная (Ka= 1,8∙10-4, рKa= 3,75).
Слабые однокислотные основания (ВОН)диссоциируют в водных растворах частично и при этом устанавливается динамическое химическое равновесие:
ВОН ↔ В++ ОН-
которое характеризуется соответствующей константой равновесия –константой основной диссоциации Kb:
Kb=[B ] +-[OH ] -/[BOH]
Константа основной диссоциации Kb(или еѐ показатель pKb= -lgKb) характеризует силу основания –чем меньше значение Kb(больше pKb), тем слабее основание, и наоборот.
