Взаимодействие металлов с простыми окислителями
Металлы в таблице Д. И. Менделеева отделены от неметаллов линией (B – Si – Ge – As – Te – Po – At), по которой расположены так называемые полуметаллы (рис. 9.3).Полуметаллы – это металлы, имеющие неметаллические модификации. Все неметаллы относятся к p-элементам. Для неметаллов характерна высокая электроотрицательность, увеличивающаяся от B к F во втором периоде и постепенно понижающаяся в последующих. Наибольшим сродством к электрону обладают p-элементы VII группы, наименьшее значение имеют атомы с конфигурацией s2p6 (Ne, Ar, Kr) или с наполовину заполненным p-подуровнем (N, P, As).
 |
Неметаллы, за исключением инертных газов, и полуметаллы относятся к простым окислителям.
Рис. 9.3. Положение неметаллов и полуметаллов в Периодической системе Д. И. Менделеева
Металлы как восстановители будут вступать в реакции с различными окислителями. Соединения металлов с галогенами называются галогенидами, с серой – сульфидами, с азотом – нитридами, с фосфором фосфидами, с углеродом – карбидами, с кремнием – силицидами, с бором – боридами, с водородом – гидридами и т.д.
Наиболее часто встречается реакция окисления металлов кислородом воздуха с образованием оксидов: Me + O2 ® MexOy.
По периоду с возрастанием порядкового номера ослабевают основные свойства оксидов элементов главных подгрупп, одновременно усиливаются их кислотные свойства (рис. 9.4) Изменения кислотно-основных свойств оксидов металлов побочных подгрупп имеет менее выраженный характер. В каждой главной подгруппе (за исключением инертных газов) с увеличением порядкового номера элемента возрастают основные свойства оксидови уменьшаются кислотные свойства.
 |
Рис. 9.4. Изменение кислотно-основных свойств оксидов металлов
главных подгрупп
По периоду слева направо у элементов увеличивается стремление к проявлению различной степени окисления. По мере увеличения степени окисления данного элемента, основные свойстваослабляются и усиливаются кислотные свойства его соединений. Для металлов, имеющих различные степени окисления, низшие оксиды обладают основными свойствами (если степень окисления металлов от 1 до 2), высшие оксиды (оксиды с максимальными степенями окисления) – кислотными (степень окисления > 4). Оксиды, где степень окисления +3, +4, – амфотерны.
Возможность реакции окислении металлов кислородом при нормальных условиях определяется величиной 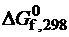 реакции.
реакции.
В энергетический эффект взаимодействия металлов с элементарными окислителями вносят вклад не только потенциал ионизации металлов и сродство к электрону окислителя, но и энергия диссоциации молекулярного окислителя. Окисление металлов галогенами происходит легче, чем кислородом, так как энергия диссоциации молекул галогенов сравнительно невелика. В связи с высокой энергией диссоциации азота (N2) лишь немногие металлы (за исключением Са, Ва, Sr) горят в атмосфере азота с образованием нитридов.
