Взаимодействие металлов с концентрированной азотной
Кислотой
Ни один металл из азотной кислоты, как разбавленной, так и концентрированной водород (H2) не вытесняет, т.к. окислителем является не ион водорода, а N+5.
Металлы любой активности взаимодействуют с концентрированной азотной кислотой по схеме:
0 +5 +4
Me + HNO3конц. → соль + H2O + NO2↑
Red Ox
любой
активности
В холодной HNO3 конц многие металлы пассивируются.
Взаимодействие металлов с разбавленной азотной кислотой
Металлы в зависимости от их активности взаимодействуют с разбавленной азотной кислотой по схеме:
–3 –3
  акт. Me акт. Me | соль + H2O + NH4NO3 (NH3) | |
| +5 | cр. акт. Me | 0 +1 |
 Me0 + HNO3 разб. Me0 + HNO3 разб. |  | соль + H2O + N2 (N2O) |
| Red Ox | мало акт. Me | +2 |
 | соль + H2O + NO | |
Взаимодействие металлов с водой
При взаимодействии металлов с водой вода является окислителем, а металл – восстановителем. Возможность взаимодействия, как и для любой ОВР, определяется условием Dj = (jок – jвос) > 0.
Прежде чем провести реакцию металла с водой, необходимо учесть не только разность потенциалов окислителя и восстановителя, но и характер образующегося продукта.
Стандартные окислительно-восстановительные потенциалы ряда металлов, кислорода и водорода в разных средах приведены в таблицах.
| Кислота (рН=0) | j, В | Вода (рН=7) | j, В | Щелочь (рН=14) | j, В |
| 2Н+/Н2 | 0,00 | 2Н2О/Н2 | -0,41 | 2Н2О/Н2 | -0,83 |
| О2/Н2О | +1,22 | О2/4ОН- | +0,81 | О2/4ОН- | +0,40 |
| Al3+/Al | -1,66 | Al(OH)3/Al | -1,88 | AlO2-/Al | -2,36 |
| Bi3+/Bi | +1,21 | BiO+/Bi | -0,04 | Bi2O3/Bi | -0,45 |
| Cd2+/Cd | -0,40 | Cd(OH)2/Cd | -0,41 | Cd(OH)2/Cd | -0,82 |
| Co2+/Co | -0,28 | Co(OH)2/Co | -0,32 | Co(OH)2/Co | -0,73 |
| Cr3+/Cr | -0,74 | Cr(OH)3/Cr | -0,93 | CrO2-/Cr | -1,32 |
| Cu2+/Cu | +0,34 | Cu(OH)2/Cu | +0,19 | Cu(OH)2/Cu | -0,22 |
| Fe2+/Fe | -0,44 | Fe(OH)2/Fe | -0,46 | Fe(OH)2/Fe | -0,87 |
| Mg2+/Mg | -2,36 | Mg(OH)2/Mg | -2,38 | Mg(OH)2/Mg | -2,69 |
| Ni2+/Ni | -0,25 | Ni(OH)2/Ni | -0,30 | Ni(OH)2/Ni | -0,72 |
| Pb2+/Pb | -0,13 | Pb(OH)2/Pb | -0,14 | PbO22-/Pb | -0,54 |
| Sn2+/Sn | -0,14 | Sn(OH)2/Sn | -0,50 | SnO22-/Sn | -0,91 |
| Zn2+/Zn | -0,76 | Zn(OH)2/Zn | -0,81 | ZnO22-/Zn | -1,22 |
Пример. Взаимодействие Al с водой
Сравниваем потенциалы металла и водорода в нейтральной среде:
j (2Н2О/Н2)= -0,41 В; j (Al(OH)3/Al)= -1,88 В;
Dj= -0,41-(-1,88) = 1,47 В>0.
Таким образом, термодинамическое условие выполняется. Записываем уравнение реакции:
| Al – 3e + 3H2O ® Al(OH)3 + 3H+ | |
| 2H2O + 2e ® H2 + 2OH- | |
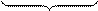 Al + 6H2O+ 6H2O ® 2Al(OH)3 +6H+ + 6OH- + 3H2 Al + 6H2O+ 6H2O ® 2Al(OH)3 +6H+ + 6OH- + 3H2 | |
| 6H2O |
Молекулярное уравнение:
Al + 6H2O = 2Al(OH)3¯ + 3H2
Образовавшаяся пленка нерастворимого гидроксида Al(OH)3 плотно прилегает к поверхности металла, защищая его от дальнейшего окисления. Следовательно, алюминий устойчив по отношению к воде. Вследствие образования нерастворимых гидроксидов не реагируют с водой цинк, хром, титан и ряд других металлов.
Практически в воде растворяются только щелочные и щелочноземельные металлы (Li……Fr, Ca…..Ra).
