Электрохимия. Потенциометрия.
Потенциометрический анализ.
Потенциометрическое титрование, сущность метода, значение для биологии и медицины.
Живой организм можно рассматривать с точки зрения электрохимии как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов.
Все биологические ткани и жидкости обладают определенной электрической проводимостью.
В медицинской практике широко применяют методы электродиагностики и электролечения, основанные на использовании электрической проводимости тканей организма и ответных реакций на электрическое воздействие.
В биологических системах образование и разрушение двойного электрического слоя на клеточных мембранах сопровождается распределением электронных импульсов вдоль нервных и мышечных волокон.
Как правило, поверхность живых клеток и тканей имеет значительный отрицательный заряд за счет ионогенных групп макромолекул белков, находящихся на поверхности.
Отрицательный заряд макромолекул белков обусловлен тем, что рН большинства сред организма превышает изоэлектрическую точку белков. Под действием электростатических сил к отрицательно заряженной поверхности клеточных мембран и тканей будет подходить положительно заряженные ионы Nа+, K+, Са2+ и др., что приведет к возникновению двойного электрического слоя.
В биологических системах образование и разрушение двойного электрического слоя на клеточных мембранах сопровождает изменения проницаемости клеточных мембран и распространения электрических импульсов вдоль нервных и мышечных волокон.
К электрокинетическим методам анализа относят методы, основанные на электрохимических явлениях: изменение ЭДС или рН раствора, сопротивления системы или ее проводимости.
Электрохимические методы анализа широко используют в медико-биологических исследованиях для качественного и количественного определения в биологических жидкостях электролитов, белков, гормонов, витаминов, ферментов и других веществ; определения степени насыщенности крови кислородом, состава выдыхаемого воздуха, определения вредных веществ в сточных водах и воздухе промышленных предприятий.
Потенциометрией называют физико-химический метод анализа, позволяющий определять концентрации ионов на основе измерения электродвижущей силы гальванической цепи, содержащей исследуемый раствор.
Для потенциометрических измерений составляют гальванический элемент из двух электродов: электрода сравнения и индикаторного; потенциал последнего зависит от концентрации (активности) анализируемых ионов. Например:
Стекл. электрод | H+(НСl), рН-? || КСlнасыщ., АgСl |Аg
Различают прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия применяется для непосредственного определения концентрации различных ионов в растворе.
Потенциометрическое титрование – это метод анализа, в котором точка эквивалентности определяется по изменению в ходе титрования электродвижущей силы гальванической цепи, содержащей анализируемый раствор. Потенциометрическое титрование состоит в том, что к анализируемому раствору, в который опущены индикаторный и стандартный электроды, порциями добавляют титрант и после каждого добавления измеряют электродвижущую силу гальванической цепи. По результатам титрования строят кривую титрования .
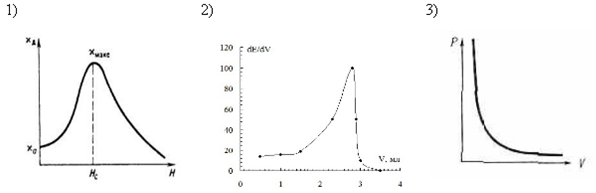
Для более точного нахождения объема рабочего раствора в момент эквивалентности пользуются дифференциальной кривой титрования. Её рассчитывают по изменению ЭДС и объема титранта в процессе титрования. График строят в дифференциальных координатах. В этом случае кривая титрования имеет максимум, соответствующий моменту эквивалентности.
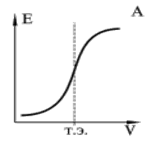
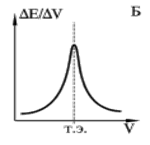
|
Кривые потенциометрического титрования:
А — кривая титрования сильной кислоты сильным основанием;
Б — дифференциальная кривая титрования.
По кривой титрования находят точку эквивалентности и объем рабочего раствора, который пошел на титрование. На основании закона эквивалентов рассчитывают концентрацию вещества в исследуемом растворе.
Методом потенциометрического титрования анализируют не только истинные растворы, но и мутные, окрашенные, коллоидные системы.
Метод потенциометрии позволяет объяснить механизм генерирования и распространения нервных импульсов, природу реакций биологического окисления и гидролиза. Метод прямой потенциометрии применяют для клинического анализа на ионы Н+, К+, Na+, Ca2+, Cl-, I-, HS- и других в биологических жидкостях, растворах лекарственных препаратов и солевых кровезаменяющих жидкостях, на молекулы глюкозы, мочевины, аминокислот, а также для контроля окружающей среды.
Контрольные вопросы
1. Понятие о двойном электрическом слое (ДЭС). Механизм образования. Термодинамика ДЭС.
2. Уравнение Нернста, его анализ. Электродный потенциал. Стандартный электродный потенциал.
3. Стандартный водородный электрод, его устройство, электродная реакция, значение.
4. Гальванические цепи для определения стандартных электродных потенциалов.
5. Электроды сравнения. Хлорсеребряный электрод, его электродная реакция, электродный потенциал.
6. Электроды определения. Стеклянный электрод, его электродная реакция, электродный потенциал.
7. Ионселективные электроды и их применение в медико-биологических исследованиях.
8. Потенциометрический анализ. Потенциометрическое титрование, сущность метода, значение для биологии и медицины.
Типовые задачи
За 













 дача 1. Составить схему гальванической цепи для измерения стандартного электродного потенциала никелевого электрода и рассчитать величину ЭДС указанного гальванического элемента.
дача 1. Составить схему гальванической цепи для измерения стандартного электродного потенциала никелевого электрода и рассчитать величину ЭДС указанного гальванического элемента.
Решение:
Стандартные параметры, при которых определяются величины стандартных электродных потенциалов:
Р = 101,325 кПа (1 атм.); Т = 298К(250С); а катиона = 1 мольˑдм– 3
1) Схема стандартного никелевого электрода:
Ni/Ni2+; E0 (Ni/Ni2+) = – 0,25 B (см. Приложение 3.4.)
2) Схема стандартного водородного электрода:
(Pt)H2/H+; E0 (Н+/½Н2) = 0 B
P(H2) = 1атм
а(Н+) = 1 моль/дм– 3
3) Схема гальванической цепи:
Pt(H2) │ H+ ║ Ni2+│Ni
p(H2) = 1атм а(Н+) = 1моль/дм3
ЭДС = 0 – (– 0,25) = 0,25В
Ответ: ЭДС = 0,25В
Задача 2. Гальванический элемент состоит из стеклянного и насыщенного хлорсеребряного электродов. При 250С ЭДС составляет 0,036 В. Рассчитать потенциал стеклянного электрода, если для данной концентрации ионов водорода потенциал насыщенного хлорсеребряного электрода выше потенциала стеклянного электрода.
Решение:
1) Запишем схему гальванической цепи:
Стеклянный электрод │ Н+ ║ AgCl │ Ag
KCl (нас)
2) Выразим ЭДС гальванического элемента и рассчитаем потенциал стеклянного электрода:
ЭДС = Е (х/с) – Е (ст.)
Е (ст.) = Е (х/с) – ЭДС
Е (х/с) = 0,222 В
Е (ст.) = 0,222 – 0,036 = 0,186 В
Ответ: Е (ст.) = 0,186 В
Задача 3. Гальванический элемент состоит из водородного электрода, опущенного в мочу с рН 5,3 и насыщенного хлорсеребряного электрода. Определить величину ЭДС при 250С.
Решение:
1) Рассчитаем потенциалы водородного электрода:
Е (Н+/½Н2) = Е0 (Н+/½Н2) + 0,059 · lgа(H+)
Так как Е0 (Н+/½Н2) = 0 В
рН = – lg a(H+)
Уравнение примет вид:
Е (Н+/½Н2) = – 0,059 · рН
Е (Н+/½Н2) = – 0,059 · 5,3= – 0,314 В
2) Сравним потенциалы водородного и насыщенного хлорсеребряного электродов:
Е (Н+/½Н2) = – 0,314 В
Е (х/с) = 0,222 В.
Е (х/с) > Е (Н+/½Н2)
3) Составим схему гальванической цепи и рассчитаем ЭДС:
(Pt)H2 │ H+ ║ AgC1 │ Ag
(кровь) КС1(нас)
ЭДС = Е (х/с) – Е (Н+/½Н2)
ЭДС = 0,222 – (– 0,314) = 0,536 В
Ответ: 0,536 В
Задача 4. Как изменится потенциал медного электрода, если раствор сульфата меди в жидкой фазе этого электрода разбавить в 5 раз? Е0 (Сu2+/Cu) = 0,34 B (см. Приложение 3.4.).
Решение:
1)Выразим потенциал медного электрода до разбавления:
Е1 (Сu2+/Cu) = E0 (Сu2+/Cu) + 0,059/2· lg а (Cu2+)
2)Выразим потенциал медного электрода после разбавления:
Е2 (Сu2+/Cu) = E0 (Сu2+/Cu) + 0,059/2· lg a (Cu2+) / 5
3)Определим разность потенциалов медного электрода до и после разбавления:
ΔЕ = Е1 – Е2
ΔЕ = Е0 (Сu2+/Cu) + 0,059/2·lg a (Cu2+) – E0 (Сu2+/Cu) + 0,059/2· lg a (Cu2+) / 5
ΔЕ = 0,0295 (lg a (Cu2+) – lg a (Cu2+) / 5)
ΔЕ = 0,0295 (lg a (Cu2+) – lg a (Cu2+) + lg 5); т.к. lg5 = 0,7
ΔЕ = 0,0295 · 0,7 = 0,02 В
Ответ: 0,02 В
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
01. УКАЖИТЕ СХЕМУ ХЛОРСЕРЕБРЯНОГО ЭЛЕКТРОДА
1) КСIнасыщ., АgОН |Аg
2) КBr, АgОН |Аg
3) Аg| АgCl, КСIнасыщ.
4) Аg| АgNO3, КNO3насыщ.
02. НА ГРАНИЦЕ РАЗДЕЛА МЕТАЛЛ – РАСТВОР СОЛИ МЕТАЛЛА ВОЗНИКАЕТ ___________ ПОТЕНЦИАЛ
1) контактный
2) диффузный
3) мембранный
4) электродный
03. УРАВНЕНИЕ НЕРНСТА ИМЕЕТ ВИД
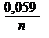
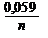 1) E = E0 ± ln aкат., ан. 2) E = E0 ±
1) E = E0 ± ln aкат., ан. 2) E = E0 ± 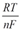 lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
lg aкат., ан. 3)E = E0 ± lg a(кат./ан.)
04. ДИФФЕРЕНЦИАЛЬНАЯ КРИВАЯ ПОТЕНЦИОМЕТРИЧЕСКОГО ТИТРОВАНИЯ ИМЕЕТ ВИД
05. ВЕЛИЧИНА СТАНДАРТНОГО ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА НЕ ЗАВИСИТ ОТ
1) концентрации вещества в растворе
2) природы электрода
3) величины ЭДС гальванического элемента
4) рН раствора
06. ПРИНЦИП ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ рН ЗАКЛЮЧАЕТСЯ В
1) измерении ЭДС цепи, состоящей из электродов определения и сравнения
2) измерении потенциала электрода сравнения
3) измерении электрической проводимости исследуемого раствора
4) измерении потенциала хлорсеребряного электрода
07. НАЙДИТЕ ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА, СОСТАВЛЕННОГО ИЗ МАГНИЕВОГО И ЦИНКОВОГО ЭЛЕКТРОДОВ ПРИ 250C, ЕСЛИ КОНЦЕНТРАЦИИ ИОНОВ Mg2+ И Zn2+ В РАСТВОРЕ ОДИНАКОВЫ И РАВНЫ 0,1 МОЛЬ/Л.
Е0 (Мg2+/Mg) = – 2,37 B; Е0 (Zn2+/Zn) = – 0,74 B
1) -1,63B
2) +1,63B
3) –3,11B
4) + 3,11B
Дополните высказывание
08. МАКСИМАЛЬНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ, ВОЗНИКАЮЩАЯ НА ГРАНИЦЕ ТВЕРДАЯ ФАЗА – РАСТВОР В МОМЕНТ УСТАНОВЛЕНИЯ ЭЛЕКТРОХИМИЧЕСКОГО РАВНОВЕСИЯ НАЗЫВАЕТСЯ _______.
09. ВЕЛИЧИНУ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА РАССЧИТЫВАЮТ ПО УРАВНЕНИЮ ___________ .
10. В ЭЛЕКТРОХИМИЧЕСКОМ РЯДУ НАПРЯЖЕНИЙ МЕТАЛЛЫ РАСПОЛОЖЕНЫ В ПОРЯДКЕ ________ ИХ АКТИВНОСТИ.
Контрольные задания
11. Рассчитать величину электродного потенциала цинкового электрода, если активная концентрация ионов цинка в жидкой фазе составляет 0,2 моль/дм3. Е0 (Zn2+/Zn) = – 0,76 В.
12. Вычислить активную концентрацию ионов меди Cu2+ в жидкой фазе медного электрода при Т = 298 К, если Е (Сu2+/Cu) = 0,8 В, Е0(Сu2+/Cu) = 0,35 В.
13. Как изменится потенциал хромового электрода, если активную концентрацию ионов Cr2+ в жидкой фазе электрода при 298 К понизить от 0,08 моль/дм3 до 0,05 моль/дм3?
Е0 (Cr2+/Cr) = – 0,913 В.
14. Для определения рН желчи была составлена водородно-хлорсеребряная цепь, ЭДС которой оказалась равной 0,577 В при 298 К. Определить потенциал водородного электрода и рассчитать рН исследуемой биологической жидкости.
(Ответ: рН = 12)
15. На миллиметровой бумаге построить калибровочный график зависимости ЭДС гальванической цепи от рН стандартных растворов по результатам потенциометрического анализа с использованием гальванической цепи включающей хлорсеребряный электрод сравнения и стеклянный электрод определения:
| рН | ЭДС, мВ |
| 1,0 | |
| 2,0 | |
| 3,0 | |
| 4,0 | |
| 5,0 |
По калибровочному графику определить рН исследуемого раствора, если ЭДС составила 150 мВ. Рассчитать концентрацию ионов Н+ в исследуемом растворе.
16. Провели потенциометрическое титрование 50 мл анализируемого раствора хлорида калия стандартным раствором нитрата серебра с молярной концентрацией С(AgNO3) = 0,10 моль/л. Получили следующие результаты: V(AgNO3) – объём прибавленного титранта, Е – ЭДС цепи соответственно:
| V(AgNO3), мл | 23,50 | 24,00 | 24,20 | 24,30 | 24,40 | 24,50 | 25,00 | 25,50 |
| Е, мВ |
Постройте кривые потенциометрического титрования и определите молярную концентрацию С(KCl) исследуемого раствора хлорида калия.
Литература
- Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов / Ю. А. Ершов, В.А. Попков, А.С. Берлянд и др.; Под ред. Ю.А. Ершова. – 5-е изд., стер. – М.: Высш.шк., 2005. – С. 450 – 451.
2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов медицинских спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; Под ред. Ю.А. Ершова, В.А. Попкова. – М. : Высш. шк., 2008. – С. 179-184.
