Потенциометрия. Применение в фармацевтическом анализе.
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона. 
При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлорсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста
 Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим: сила тока, протекающего через ячейку, должна быть равна 0; время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим: сила тока, протекающего через ячейку, должна быть равна 0; время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
 При измерении ЭДС в таких условиях можно считать, что величина соотношения aOx/ared у поверхности электрода равна величине этого соотношения в растворе
При измерении ЭДС в таких условиях можно считать, что величина соотношения aOx/ared у поверхности электрода равна величине этого соотношения в растворе
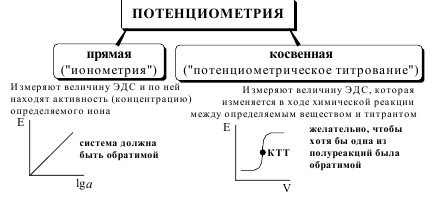
В прямой потенциометрии концентрацию (активность) опреде-ляемого вещества рассчитывают, исходя из величины ЭДС гальванического элемента. Чаще всего индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометрические измерения, в которых используется ионоселективный электрод, называются ионометрией. Данный метод анализа характеризуется простотой и экспрессностью методик, недорогой аппаратурой. Потенциометрическим титрованием называется метод анализа, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом. При потенциометрическом титровании конечную точку титрования находят, измеряя электродвижущую силу (э.д.с.) электродной пары, состоящей из индикаторного электрода и электрода сравнения или двух индикаторных электродов, погруженных в испытуемый раствор, как функцию количества прибавленного титранта. В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осадительные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции. Например, при кислотно-основном титровании обычно используют стеклянный рН-чувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплексонометрическом – электрод, чувствительный по отношению к ионам определяемого металла и т.д. Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана.
