Количественные характеристики гидролиза
Количественно гидролиз можно охарактеризовать при помощи константы гидролиза (KГ) и степени гидролиза (h).
В обратимой реакции гидролиза концентрация одного из участников – воды – меняется мало, поэтому из выражения для константы равновесия этой реакции можно воду исключить. Полученное выражение характеризует константу гидролиза.
Константа гидролиза (KГ) - это отношение равновесных концентраций продуктов гидролиза к равновесной концентрации иона, подвергающегося гидролизу.
NH4+ + H-OH ⇄ NH3×H2O + H+.
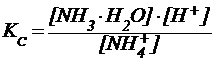
Умножая числитель и знаменатель одновременно на [OH-], получим:
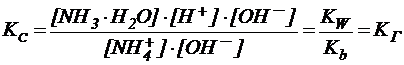
Константа гидролиза KГ - величина постоянная, характеризующая способность соли подвергаться гидролизу. Значение KГ зависит от природы соли и не зависит от концентрации раствора. С ростом температуры константа гидролиза растёт, поскольку ионное произведение воды увеличивается в большей степени, чем константы диссоциации слабых электролитов.
Аналогично легко получаются формулы для расчёта констант гидролиза при различных его типах:
1) При гидролизе по катиону (например,NH4Cl):
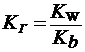 | (19) |
Чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
2) При гидролизе по аниону (например,CH3COONa):
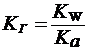 | (20) |
Чем слабее кислота, тем в большей степени подвергаются гидролизу её соли.
3) При гидролизе по катиону и аниону одновременно (например, NH4CN):
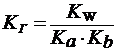 | (21) |
Чем слабее кислота и основание, образующие соль, тем в большей степени протекает гидролиз соли.
При ступенчатом гидролизе в выражения для константы гидролиза следует подставлять величину константы диссоциации той частицы, которая образуется при гидролизе. Например, первая константа гидролиза карбоната натрия описывается с помощью второй константы диссоциации угольной кислоты, которая соответствует диссоциации образующейся частицы НСО3-, тогда как вторая константа гидролиза этой соли описывается с помощью первой константы угольной кислоты, которая образуется на второй стадии гидролиза:
СO32- + H-OH ⇄ HСO3- + ОН-
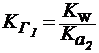 | (22) |
HСO3- + H-OH ⇄ H2СO3 + ОН-
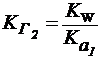 | (22¢) |
Так как 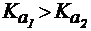 , следовательно,
, следовательно, 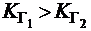 . Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
. Таким образом, по первой ступени гидролиз солей всегда протекает в большей степени.
Степень гидролиза (h) - отношение количества гидролизованной части соли к общему количеству растворённой соли, обычно выражаемое в процентах.
Если, например, в воде было растворено 2 моль соли, а гидролизу подверглось 0,01 моль, то 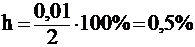 .
.
Степень гидролиза зависит от многих факторов:
В первую очередь, она зависит от химической природы составляющих данную соль ионов. Так, в растворах CH3COONa и NaCN с молярными концентрациями 0,1 моль/л при 250С степень гидролиза солей различна:
h(CH3COONa) = 0,01%, a h(NaCN) = 1,5%.
Это объясняется различной силой кислот, составляющих соли:

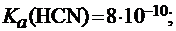
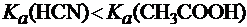 .
.
Таким образом:
Чем слабее кислота (основание), образующие соль, тем больше степень гидролиза.
Степень гидролиза сильно меняется c изменением температуры раствора соли. Действительно, процесс гидролиза является эндотермическим, и в соответствии с принципом Ле Шателье равновесие обратимой реакции смещается в сторону эндотермического процесса при увеличении температуры, поэтому:
Чем выше температура, тем больше степень гидролиза.
Степень гидролиза зависит от концентрации раствора. Гидролиз, как взаимодействие с водой, протекает тем полнее, чем больше в растворе воды, т.е. чем разбавленнее раствор. Однако это правило действует только в случае солей, гидролизующихся по одному иону – катиону или аниону. При совместном гидролизе по катиону и аниону концентрация соли практически не сказывается на степени гидролиза.
Чем меньше концентрация раствора соли, гидролизующейся по катиону или по аниону, тем больше степень гидролиза.
Степень гидролиза может быть выражена через константу гидролиза:
1) При гидролизе по катиону (например, для NH4Cl):
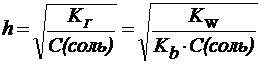 . . | (23) |
2) При гидролизе по аниону (например, для CH3COONa):
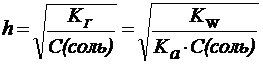 | (24) |
3) При гидролизе по катиону и аниону одновременно (например, дляNH4CN):
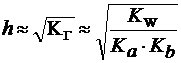 | (25) |
