Тема 1.3 Растворы и дисперсные системы
Растворы и их природа
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами.
В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные.
В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы.
1. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0).
2. Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0).
Независимо от знака энтальпии при растворении всегда:
ΔG = ΔH – T∙ΔS < 0
Способность вещества растворяться в том или ином растворителе называется растворимостью. Количественно растворимость вещества часто выражается массой вещества, растворяющегося в 100 г растворителя.
Таблица 6. Растворимость веществ в воде
| Растворимость, г/100 г растворителя | Характеристика вещества | Пример |
| Более 10 | Хорошо растворимое | Нитрат калия |
| 10-1 | Растворимое | Хлорид натрия |
| Меньше 1 | Малорастворимое | Сульфат кальция |
| Меньше 0,01 | Практически нерастворимое | Иодид серебра |
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
Растворы делятся на идеальные и реальные. Для идеальных растворов взаимодействием между компонентами раствора можно пренебречь. Следовательно, свойства раствора определяются как сумма свойств растворенных веществ. Например, при смешении близких по свойствам бензола и толуола давление пара P над раствором в соответствии с законом Дальтона будет аддитивной (получаемой сложением) величиной:
P = χ(Б) Pб0 + χ(Т)PT0
Здесь и χ(Б), и χ(T) – соответственно молярные доли бензола и толуола.
Если раствор сохраняет свойства идеальности при любых концентрациях, его называют совершенным (растворы изотопов). Часто раствор приобретает эти качества только при достаточно большом разведении, это – «бесконечно разбавленный» раствор при χ→0. Во всех прочих случаях раствор считается реальным.
Закон Генри
Если растворенное вещество характеризуется большой упругостью пара по сравнению с упругостью пара растворителя (PB >> PA) и при этом оба компонента раствора химически инертны, то растворение такого газообразного вещества в жидкости подчиняется закону Генри: при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB:
PB = KH χ(B)
Законы Рауля
Если упругость пара растворенного вещества очень мала PB << PA , то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
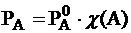
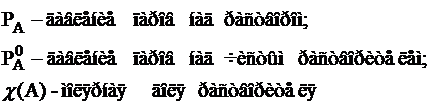
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворителя.
После подстановки 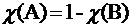 и несложных преобразований
и несложных преобразований
получаем:
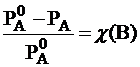
Относительное понижение упругости пара над раствором равно молярной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде  формируются как второй закон Рауля – повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества:
формируются как второй закон Рауля – повышение температуры кипения и понижение температуры замерзания раствора прямо пропорционально моляльной концентрации растворенного вещества:
ΔT = K Cm (B) 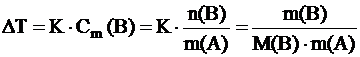
Коэффициенты пропорциональности носят, соответственно, название эбулиоскопического (определяет повышение температуры кипения раствора по отношению к температуре кипения растворителя) и криоскопического (определяет понижение температуры замерзания раствора по отношению к температуре замерзания растворителя).
Таблица 7. Эбуллиоскопические и криоскопические константы некоторых растворителей
| Растворитель | Кэбул., 0С×кг/моль | Ккрио., 0С×кг/моль |
| Вода | 0,52 | 1,86 |
| Бензол | 2,57 | 5,10 |
| Анилин | 3,69 | 5,87 |
Эбулиоскопический и криоскопический коэффициенты определяются только природой растворителя (см. табл.7).
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения:
C m(B) = 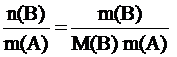
где: m(B) – масса растворенного вещества, г;
m(A) – масса растворителя, кг;
M(B) – молярная масса растворенного вещества, г/моль.
ΔT = K Cm (B) = 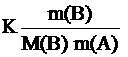
Экспериментально определив ΔT и подставив в уравнение наряду с K, массой растворенного вещества и массой растворителя мы получим уравнение с одним неизвесным - молярной массой растворенного вещества.
Осмос
Если разделить мембраной, через которую способны проходить только молекулы растворителя, два раствора, в которых различны концентрации растворенного вещества χ1(B) и χ2(B), то возникнет процесс перехода через мембрану растворителя из того раствора, где концентрация растворенного вещества ниже в тот раствор, где концентрация растворенного вещества выше.
