Проведение калориметрических измерений
Экспериментальное определение теплового эффекта проводится в специальном приборе – калориметре, который представляет собой сосуд Дьюара с укрепленным в нем термометром Бекмана (см. инструкцию по работе с термометром Бекмана).
Для проведения реакции нейтрализации используют растворы кислоты и основания, концентрации которых отличаются в пять раз, при одинаковой температуре (комнатной). Объемы взятых для реакции растворов должны соответствовать закону эквивалентов. Объем сосуда Дьюара на 500 мл позволяет взять для опыта 250 мл менее концентрированного раствора электролита и 50 мл более концентрированного. В этом случае вещества взяты в эквивалентных количествах. Количество каждого электролита в растворе вычисляется по формуле:
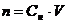 ,
,
где Сн – концентрация, моль-экв/л, V – объем раствора, л.
Реакция нейтрализации, проводимая в сосуде Дьюара, сопровождается выделением теплоты, что приводит к нагреванию или охлаждению всей системы. Изменение температуры Δt в результате химической реакции фиксируется с помощью разностного термометра Бекмана.
При калориметрических измерениях для учета теплообмена калориметра с окружающей средой и определения истинного изменения температуры во время опыта весь калориметрический процесс делится на три периода:
1) предварительный период, продолжающийся 2-5 мин.;
2) главный период – химическая реакция;
3) заключительный период – 2-5 мин.
Настроенный на необходимую температуру термометр Бекмана помещают в калориметр, через равные промежутки времени (обычно 30 сек.) фиксируют значения температуры, которая изменяется вследствие теплообмена с окружающей средой. Когда ее ход станет равномерным, ее отсчет проводят еще в течение 2-5 минут. Это предварительный период. Затем, не прекращая наблюдения за температурой, осуществляют изучаемый процесс в калориметре. При этом с течением времени температура достаточно резко изменяется. Это главный период. Концом главного и началом заключительного периода принято считать установление вновь равномерного хода изменения температуры. В заключительном периоде температура отмечается так же, как и в предварительном, 2-5 минут. Для расчета точного изменения температуры при изучаемом процессе на миллиметровой бумаге чертят график, где на оси абцисс откладывают время, а по оси ординат – соответствующие значения температуры. Пропуски фиксировавшихся моментов времени и соответствующих значений температуры не допускаются.
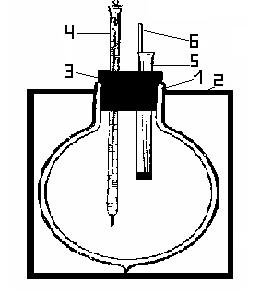
Рис. 2.1 Схема калориметра
1– сосуд Дьюара
2 – штатив
3 – пробка с отверстиями
4 – термометр Бекмана или термометр ртутный с ценой деления 0,1°С
5 – стеклянная трубка, закрытая пробкой
6 – стеклянная палочка
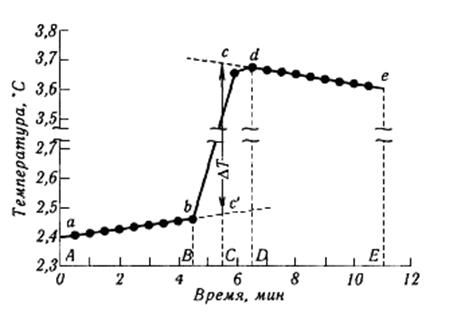
Рис. 2.2. Ход температуры при калориметрических измерениях.
Примерный график хода температуры изображен на рис. 2.2. Предварительный и заключительный периоды на графике представляются двумя прямыми, наклон которых зависит то разности температур калориметра и окружающей среды. На рис.2.2 АВ – предварительный период, ВД – главный и ДЕ – заключительный. Для учета теплообмена с окружающей средой и нахождения истинного значения изменения температуры продолжают прямую линию, соответствующую предварительному периоду (ab), вправо, а прямую заключительного периода (de) – влево (см. рис. 2.2). На середине главного периода (в точке С на графике) проводят прямую параллельно оси ординат до пересечения с пунктирными линиями. Расстояние между точками пересечения равно исправленному значению изменения температуры, сопровождающего процесс в калориметре. По найденному значению Dt вычисляют тепловой эффект по уравнению:
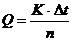 (2.1)
(2.1)
где К – постоянная калориметра (теплоемкость калориметра), т.е. количество теплоты в Дж (кДж), которое требуется для нагревания всей системы на 1 градус; n – количество кислоты или щелочи (моль), взятое для опыта. Значение К обычно находят предварительно по известной теплоте растворения какой-либо соли. В данной работе ее указывает преподаватель.
Цель работы.
1. Определить тепловой эффект реакции нейтрализации кислоты (основания) раствором основания (кислоты). Научиться готовить растворы заданной молярной и нормальной концентрации из твердого вещества и разбавлением.
2. Определить теплоту диссоциации слабого электролита.
Реактивы.
· Раствор сильной кислоты (H2SO4, HCl или HNO3 – по указанию преподавателя).
· Раствор уксусной кислоты (CH3COOH).
· Раствор щелочи (NaOH или KOH).
Концентрации растворов кислоты и щелочи должны различаться в пять раз.
Оборудование и посуда.
· Прибор для определения тепловых эффектов (калориметр)..
· Термометр ртутный на 50-100°С.
· Мерные колбы на 250 мл и 50 мл.
· Стеклянные воронки 2 шт. (для кислоты и щелочи).
· Термостойкий химический стакан или термостойкая колба на 200-250 мл (для подогревания воды, необходимой для настройки термометра Бекмана).
· Электрическая плитка.
Выполнение работы.
1. Собирают калориметр, как показано на рис. 2.1.
2. В мерную колбу на 250 мл наливают 0,1 н раствор сильной кислоты (или щелочи). В мерную колбу на 50 мл наливают соответственно 50 мл 0,5 н раствора щелочи (или кислоты соответственно).
3. 250 мл 0,1 н раствора вносят в калориметр. Закрывают сосуд Дьюара пробкой с двумя отверстиями. Одно отверстие предназначено для термометра, второе – для добавления позже раствора с большей концентрацией.
4. Вставляют термометр в пробку калориметра.
5. Производят отсчет температуры каждые 30 сек. до установления ее равномерного хода либо до постоянного значения температуры (одинаковые значения не менее 5 раз). Значения температуры заносят в таблицу 1 (см. ниже).
6. Через стеклянную трубку в пробке калориметра быстро вливают 50 мл 0,5 н раствора, закрывают трубку пробкой и перемешивают раствор. При этом не прерывают отсчет времени и продолжают отмечать температуру каждые 30 сек. Температура при реакции нейтрализации повышается. Если по какой-либо причине отсчет температуры не был произведен в очередной раз, то при записи ставится прочерк. Повышение температуры, сопровождающее реакцию нейтрализации – главный период в опыте. Он продолжается до установления вновь равномерного хода температуры.
7. Когда наблюдается равномерный ход температуры (или устанавливается ее постоянное значение) в течение двух минут, опыт прекращают.
8. Повторяют точно так же опыт с использованием раствора слабой кислоты.
Таблица 1
Изменение температуры во время опыта
| Время, мин | Значения температуры | ||
| предварительный период | главный период | заключительный период | |
Обработка результатов.
1. По данным таблицы 1 для двух опытов строят графики зависимости температуры от времени и определяют Δt. Для расчета точного изменения температуры во время реакции нейтрализации вычерчивают на миллиметровой бумаге график, откладывая на оси абсцисс время, а на оси ординат – изменения температуры за каждые полминуты. График лучше строить в следующем масштабе: 1°С соответствует 5 см, а 1 мин – 1 см. Рассчитывают теплоту (энтальпию) нейтрализации сильной и слабой кислоты по формуле (2.1). Значение постоянной калориметра К указывает преподаватель.
2. Рассчитывают теплоту (энтальпию) диссоциации слабой кислоты (или слабого основания).
3. Результаты для двух определений представляют в виде таблицы 2.
Таблица 2
Результаты работы
| № п/п | Электролит | К | Dt (из графика) | Qнейт. на 1 моль | Qдисс. слабого электролита |
Контрольные вопросы и задачи.
1. Что является первоисточником энергии для всех живых организмов? Во что превращается эта энергия?
2. Какие реакции называются экзотермическими и эндотермическими? Приведите примеры таких реакций в организме человека.
3. Дайте формулировку закона Гесса и поясните его на конкретном примере.
4. Что называется теплотой нейтрализации?
5. Сформулируйте закон постоянства теплот нейтрализации. К каким электролитам он применим, а для каких электролитов не соблюдается и почему?
6. Одинаковый ли тепловой эффект будет при: а) нейтрализации азотной кислоты едким натром; б) азотистой кислоты едким кали?
7. При нейтрализации 100 мл 0,2М раствора соляной кислоты эквивалентным количеством гидроксида аммония в водном растворе выделилось 1,028 кДж теплоты. Определите теплоту реакции нейтрализации соляной кислоты гидроксидом аммония и вычислите теплоту диссоциации гидроксида аммония.
