Коллоидные растворы как дисперсные системы
Гетерогенные системы, в которых одна составная часть распределена в мелкораздробленном состоянии в среде другой, называются дисперсными системами.
Составная часть дисперсной системы, распределённая в виде отдельных мелких твёрдых частиц, капелек жидкости или пузырьков газа, составляет дисперсную фазу, а другая часть, окружающая частицы дисперсной фазы, называется дисперсионной средой. В данной работе рассматриваются дисперсные системы с жидкой дисперсионной средой.
В зависимости от размера частиц дисперсной фазы различают следующие виды дисперсных систем:
а) грубодисперсные — более 10–5 м;
б) средней степени дисперсности — 10–7...10–5 м;
в) коллоидной степени дисперсности — 10–9...10–7 м.
Более мелкие частицы с размерами порядка 10–9 м — это молекулы и ионы, которые, находясь в растворе, не создают отдельную фазу. Поэтому системы с частицами меньше 10–9 м являются истинными растворами.
Частицы систем грубой и средней степени дисперсности различимы визуально. Если они распределены в жидкости или газе, то постепенно оседают или всплывают. Такие системы называют взвесями. Взвеси могут существовать в виде суспензий или эмульсий. В первом случае твёрдое вещество взвешено в жидкости (мел в воде), во втором — жидкое вещество в жидкости (органическое жидкое вещество в воде, например, частицы жира в молоке). Примерами систем средней дисперсности являются дымы и туманы в воздухе, взвеси глины и песка в воде.
В коллоидных системах дисперсная фаза ввиду малых размеров визуально неразличима при любом увеличении. Тем не менее, размеры частиц дисперсной фазы значительно превышают молекулярные. Дисперсная фаза нерастворима в дисперсионной среде и отделена от неё поверхностью раздела; таким образом, коллоидные системы являются гетерогенными системами в отличие от истинных растворов, которые являются гомогенными, однородными. Если при жидкой дисперсионной среде дисперсная фаза — твёрдое вещество, коллоидная система называется золем; если дисперсная фаза — жидкость, система называется эмульсией.
Чем выше степень раздробленности дисперсной фазы, тем бо́льшая поверхность раздела между дисперсной фазой и дисперсионной средой приходится на единицу массы дисперсной фазы (так называемая удельная поверхность). Наличие высокоразвитой поверхности раздела в коллоидных системах обусловливает значительный избыток так называемой поверхностной энергии. Поэтому коллоидные системы являются неустойчивыми системами, поскольку всегда стремятся к самопроизвольному уменьшению поверхностной энергии за счет уменьшения межфазной поверхности путем снижения дисперсности. При этом частицы дисперсной фазы укрупняются, образуя более крупные агрегаты и затем выделяясь в виде отдельной фазы: твердой в виде осадка или жидкой в виде отдельного несмешивающегося слоя (такой процесс называется коагуляцией дисперсной системы — об этом см. раздел 1.4.).
Свойство коллоидных систем противостоять увеличению размер частиц вследствие их агрегации называется агрегативной устойчивостью системы. Для ее обеспечения необходимо присутствие в системе стабилизатора. В большинстве случаев стабилизатором является электролит, находящийся в растворе (см. раздел 1.3.).
Получение коллоидных систем
Коллоидные системы занимают промежуточное положение между среднедисперсными и молекулярно-дисперсными системами, поэтому их можно получить принципиально различными методами: дроблением более крупных по размеру частиц до коллоидной степени дисперсности (методы диспергирования) или укрупнением частиц путем соединения атомов и молекул в агрегаты (методы конденсации).
Основные условия, необходимые для получения и длительного хранения коллоидных систем, независимо от способов их получения, следующие:
1) нерастворимость частиц дисперсной фазы в дисперсионной среде;
2) достижение частицами дисперсной фазы коллоидной степени дисперсности (10–9...10–7 м);
3) наличие в системе третьего компонента — стабилизатора, который обеспечивает агрегативную устойчивость.
Методы диспергирования
Данные методы основаны на уменьшении крупных частиц до размера коллоидных и подразделяются на три группы:
а) Метод механического диспергирования. Этот метод заключается в дроблении дисперсной фазы в специальных мельницах и последующем смешении ее с дисперсионной средой.
б) Метод электрического диспергирования. Основан на образовании электрической дуги между электродами, подсоединенными к источнику тока. Электроды диспергируемого металла помещают под воду и подводят друг к другу на такое расстояние, чтобы возникла электрическая дуга.
в) Ультразвуковой метод. Дробление вещества, находящегося в дисперсионной среде, происходит под действием высокочастотных звуковых волн. При прохождении ультразвуковой волны в жидкости происходят быстро меняющиеся сжатия и расширения, которые создают разрывающие усилия и ведут к диспергированию взвешенных частиц.
Методы конденсации
Различают две группы методов конденсации:
1) Методы физической конденсации:
а) Метод конденсации паров. Примером может служить образование атмосферного тумана при конденсации влаги воздуха, происходящей при понижении температуры.
б) Метод замены растворителя. К истинному раствору (гомогенная система ионно-молекулярной степени дисперсности) какого-либо вещества в большом количестве добавляют другую жидкость, являющуюся плохим растворителем для этого вещества, но хорошо смешивающуюся с исходным растворителем. Например, приливая спиртовой раствор серы (хорошая растворимость) к воде (в ней сера мало растворима), можно получить золь серы в воде.
2) Методы химической конденсации:
В данном методе используются различные типы реакций, из которых ограничимся рассмотрением двух типов:
а) Реакции двойного обмена. Такие реакции протекают при смешении растворов двух растворимых веществ, реагирующих с образованием осадка малорастворимой соли. Примером реакции обмена является получение золя сульфида мышьяка, который выпадает в осадок при пропускании сероводорода через разбавленный водный раствор мышьяковистой кислоты:
2Н3АsО3 + 3Н2S = Аs2S3↓+6Н2O.
б) Реакции гидролиза. Этим методом пользуются обычно для получения золей гидроксидов металлов. Например, в результате гидролиза хлорида железа (III) образуются мелкие частицы осадка гидроксида железа:
FeCl3 + 3Н2O ←→ Fe(OH)3↓ + 3НCl.
Протеканию гидролиза способствуют невысокая концентрация соли и нагревание раствора, поэтому получение золя гидроксида железа (III) производят в кипящей воде.
Строение мицелл золей
В настоящее время общепринятой теорией строения коллоидных частиц является мицеллярная теория, согласно которой дисперсная фаза в системах коллоидной степени дисперсности представлена в виде мицелл. Мицелла — это агрегат молекул и ионов, состоящий из ядра и двойного электрического слоя. Хотя сами мицеллы электронейтральны, на поверхности каждой из них концентрируется электрический заряд определенного знака — либо положительного, либо отрицательного. Наличие одноимённого заряда у всех частиц данного золя является важным фактором его устойчивости. Заряд препятствует сближению частиц, а значит, предотвращает их слипание, укрупнение и выпадение в виде осадка.
Причиной возникновения заряда является процесс адсорбции ионов того или иного знака на поверхности частиц, происходящий в соответствии с правилом Пескова—Фаянса*:
На поверхности ядра мицеллы адсорбируются из раствора преимущественно те ионы, которые входят в кристаллическую решетку ядра и содержатся в растворе в избытке.
В качестве примера получения золя, образования и строения его мицеллы рассмотрим реакцию двойного обмена:
2H3AsO3 + 3H2S = As2S3↓ + 6H2O.
В случае если одно из веществ взято в избытке, оно будет выполнять роль стабилизатора. Другое вещество будет в недостатке, что предотвращает рост зародышей коллоидных частиц до крупных размеров. Молекулы As2S3, конденсируясь, образуют ядро мицеллы m[As2S3] (m означает число молекул сульфида мышьяка).
При избытке, например, H2S он будет являться стабилизатором. Сероводород диссоциирует по уравнению:
H2S ←→ H+ + HS–.
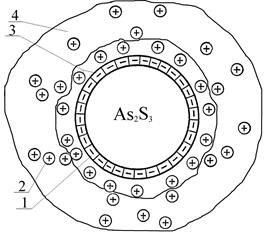 |
| Рис. 11. Строение мицеллы золя сульфида мышьяка (1 — ионы HS–; 2 — ионы H+; 3 — адсорбционный слой; 4 — диффузный слой) |
По правилу Пескова-Фаянса на ядре m[As2S3] будут адсорбироваться, как родственные и находящиеся в растворе в избытке, ионы nHS– (рис. 11). Эти ионы плотно прилегают к ядру и называются потенциалопределяющими. Они определяют знак заряда на поверхности твердых частиц — гранул.
Отрицательно заряженные ионы HS– притягивают из раствора часть находящихся в избытке ионов Н+, образующих слой противоионов (n–x)H+ в адсорбционном слое.
Ядро m[As2S3] и адсорбционный слой (куда входят ионы nHS– и противоионы (n–х)Н+) образуют гранулу, несущую отрицательный заряд, так как ионов nHS– больше, чем (n–x)H+ на число х. Другая часть противоионов хН+ образуют диффузный слой в составе двойного электрического слоя, окружающего ядро мицеллы.
Формула золя сульфида мышьяка:
 {[mAs2S3] · nHS– · (n–x)H+ }x– xH+
{[mAs2S3] · nHS– · (n–x)H+ }x– xH+
 | < ядро >| <адсорбционный > <диффузный>
| < ядро >| <адсорбционный > <диффузный>
| | слой слой
|< -------- гранула ------------->
| < -------------- мицелла ---------------------- >
Итак, двойной электрический слой состоит из адсорбционного слоя (в нем содержатся родственные потенциалопределяющие ионы и часть противоионов) и диффузного слоя противоионов.
В электрическом поле гранула, имеющая отрицательный заряд, перемещается к положительному электроду, а противоионы — к отрицательному.
Явление коагуляции
Коагуляция — процесс слипания частиц дисперсной фазы с образованием более крупных агрегатов. Внешне коагуляция проявляется в помутнении золя, в изменении его окраски, в выпадении твёрдой фазы в осадок или в образовании студнеобразной массы.
Коагуляция происходит вследствие полной или частичной потери защитного слоя, например двойного электрического слоя. Её можно вызвать нагреванием, замораживанием, интенсивным перемешиванием, прибавлением к золю электролита.
Коагуляция при нагревании происходит, потому что, во-первых, кинетическая энергия частиц возрастает и электростатическое отталкивание диффузных слоев при сближении мицелл не может препятствовать соприкосновению частиц. Во-вторых, при повышении температуры в результате десорбции (процесс, обратный адсорбции) уменьшается количество потенциалопределяющих ионов; следовательно, уменьшается число противоионов, в том числе, и в диффузном слое, который становится тоньше и перестает выполнять защитную функцию.
Наиболее изучена коагуляция электролитами. Минимальная концентрация электролита, достижение которой в коллоидном растворе вызывает коагуляцию золя, называют порогом коагуляции.
Порог коагуляции оценивается как молярная концентрация эквивалента вещества-коагулянта, измеряется в ммоль экв/л (по ранее применявшейся терминологии — «нормальная концентрация», мг-экв/л) и может быть рассчитан по формуле:
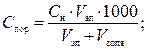 (5)
(5)
где Сн — молярная концентрация эквивалента вещества в добавленном электролите-коагулянте, моль экв/л; Vэл и Vзоля — соответственно объёмы добавленного электролита и исходного золя, л;
1000 — коэффициент перехода от моль экв/л к ммоль экв/л.
Коагуляция электролитами подчиняется правилам Шульце—Гарди*, которые можно сформулировать следующим образом:
1) коагуляцию вызывает ион, заряженный противоположно грануле золя;
2) чем больше заряд коагулирующего иона, тем сильнее его коагулирующее действие.
Механизм действия электролитов основан на том, что увеличение общей концентрации ионов в растворе приводит к сжатию диффузного слоя противоионов вокруг мицеллы, причем действие оказывают преимущественно ионы коагулянта, имеющие одинаковый заряд с ионами диффузного слоя. С увеличением заряда z коагулирующего иона его действие многократно возрастает. Количественно второе правило Шульце—Гарди выражается зависимостью:
Спор~ 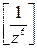 (6)
(6)
Следовательно, для одно-, двух-, и трехзарядного ионов пороги коагуляции будет относиться друг к другу как
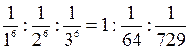 ,
,
а соотношение объёмов электролитов, которые надо добавить для достижения коагуляции, будет обратным.
Примеры решения задач
Пример 1. Определение заряда коллоидных частиц.
Золь иодида серебра AgI получен при добавлении к 0,02 л 0,01 н. раствора KI 0,028 л 0,005 н. AgNO3. Определить заряд полученного золя и написать формулу его мицеллы.
Решение. При смешивании растворов AgNO3 и KI протекает реакция:
AgNO3 + KI = AgI↓ + KNO3.
Определяем количества AgNO3 и KI, участвующих в реакции:
AgNO3 0,005·0,028 = 1,4 . 10–4 ммоль;
KI 0,02.0,01 = 2,0·10–4 ммоль.
Расчёт показывает, что в растворе имеется избыток KI, следовательно, ядром коллоидных частиц золя иодида серебра будут адсорбироваться ионы I– и частицы золя приобретут отрицательный заряд. Противоионами будут ионы К+. Формула мицеллы золя иодида серебра при условии избытка KI имеет вид:
{m[AgI]·nI–·(n–x)K+}x– xK+.
Пример 2. Определение минимального объёма электролита, необходимого для получения золя.
Какой объём 0,002 н. раствора BaCl2 надо прибавить к 0,03 л 0,0006 н. Al2(SO4)3, чтобы получить положительно заряженные частицы золя сульфата бария? Написать формулу мицеллы золя BaSO4.
Решение. Образование золя BaSO4 происходит по уравнению:
BaCl2 + Al2(SO4)3 = 3BaSO4↓ + 2AlCl3.
Если вещества участвуют в стехиометрических соотношениях, то для реакции необходим объем раствора BaCl2:
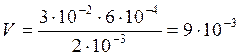 (л).
(л).
Для получения положительных частиц золя BaSO4 в растворе должен быть избыток хлорида бария по сравнению с сульфатом алюминия. Следовательно, для реакции нужно взять больше чем 0,009 л 0,002 н. раствора BaCl2.
Формула мицеллы золя сульфата бария:
{m[BaSO4]·nBa2+·2(n–x)Cl–}x– 2xCl–.
Пример 3. Вычисление порога коагуляции электролита.
В каждую из трёх колб налито по 0,01 л золя хлорида серебра. Для достижения коагуляции золя в первую колбу добавлено 0,002 л 1 н. NaNO3, во вторую 0,012 л. 0,01 н. Сa(NO3)2; в третью 0,007 л 0,001 н. Al(NO3)3. Вычислить пороги коагуляции электролитов, определить знак заряда частиц золя.
Решение. Вычисляем пороги коагуляции для каждого из добавляемых электролитов по формуле (5):
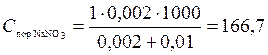 ммоль/л;
ммоль/л;
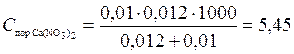 ммоль/л;
ммоль/л;
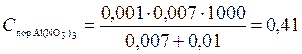 ммоль/л.
ммоль/л.
Добавляемые электролиты NaNO3, Ca(NO3)3 и Al(NO3)3 cодержат одинаковый анион NO3– и катионы Na+, Ca2+, Al3+, различающиеся величиной заряда. Поскольку действие электролитов различно, коагулирующим действием обладает катион, причем наибольшим действием — трехвалентный ион алюминия. Это следует из наименьшего значения порога коагуляции для Al(NO3)3. Также соотношение значений порогов для ионов разных зарядов соответствует второму правилу Шульце—Гарди (формула (6)). Итак, частицы золя хлорида серебра заряжены отрицательно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Содержание работы:
1. После ознакомления с теоретическим материалом выполнить опыты и записать наблюдения.
2. Записать формулы мицелл получаемых золей, сделать выводы о заряде частиц золей.
