Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции
В данном опыте используется химическая реакция взаимодействия сульфита натрия Na2SO3 с иодатом калия KIO3 в кислой среде, которая может быть выражена уравнением:
5Na2SO3 + H2SO4 + 2KIO3 = I2 + 5Na2SO4 + K2SO4 + H2O.
Появление йода легко обнаруживается в присутствии крахмала по окрашиванию раствора в синий цвет.
Моментом начала реакции считают момент сливания реагентов, а концом реакции – момент выделения свободного иода в достаточном количестве для визуального наблюдения по появлению синей окраски в растворе. Таким образом, используя секундомер или часы с отсчетом секунд, можно определить время течения процесса. Изменяя концентрацию раствора одного из реагентов (в проводимом опыте — иодата калия), можно установить зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре.
Для выполнения опыта в три стакана (пронумерованы 1, 2, 3) налить по 20 мл раствора сульфита натрия Na2SO3 , подкисленного серной кислотой и содержащего небольшое количество крахмала (в склянке находится уже готовый раствор!). В трех других стаканах (пронумерованы 1`, 2`, 3`) приготовить по 30 мл растворов KIO3 с различной концентрацией, для чего в первый стакан налить 30 мл раствора KIO3 из имеющейся склянки с раствором, во второй — 20 мл раствора KIO3 и 10 мл воды; в третий — 10 мл раствора KIO3 и 20 мл воды.
Слить по очереди попарно растворы Na2SO3 и KIO3 (рекомендуется раствор тиосульфата натрия быстро вылить в стакан с раствором KIO3) и определить по секундомеру время τ с момента сливания до появления синего окрашивания в каждом стакане. Результаты опыта занести в таблицу по форме таблицы:
| № стакана | Объем, мл < | Концентрация KIO3 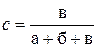 | Промежуток времени от начала отсчета до появления окраски, τ, с | Скорость реакции, 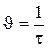 , с–1 , с–1 | ||
| Na2SO3 | H2O | KIO3 | ||||
| а | б | в | ||||
Произвести в каждом случае расчет концентрации (относительного содержания) KIO3 и скорости реакции по формулам, приведенным в верхней строке таблицы. Сделать вывод о зависимости скорости реакции от концентрации.
Результаты опыта представить в виде графика зависимости скорости реакции от концентрации иодата калия υ=ƒ(с). На оси абсцисс откладывают значения концентрации KIO3, а на оси ординат – значения скорости реакции (в условных единицах).
При построении графика масштабы по его осям выбирают таким образом, чтобы график занимал около четверти тетрадного листа. Сначала определяют диапазон изменения каждой величины, затем решают, какой интервал должны охватывать величины, изображаемые на каждой из осей, чтобы этот интервал был в 1,2-2,0 раза больше, чем диапазон действительного изменения скорости, концентрации или температуры. Интервал отмечаемых на осях численных значений не должен обязательно начинаться от нуля, но должен начинаться и заканчиваться числами как можно с меньшим количеством значащих цифр – не нулей (например, интервал температуры от 20 до 50 °С, а не от 22 до 48 °С). Интервал делят на равные части, число которых — обычно от трех до десяти — выбирают так, чтобы наносимые на оси значения величин также представляли числа с наименьшим количеством значащих цифр, не являющимися нулями (например, 1,00–1,25–1,50–1,75–2,00, а не 1,00–1,33–1,67–2,00). После этого выбирают удобный масштаб по каждой из осей графика. Числовые значения величин, определенных в ходе эксперимента (температура) или рассчитанные (скорость реакции) на осях графика не отмечают, а просто изображают каждую точку на плоскости графика по ее координатам, сообразуясь с выбранным масштабом.
Опыт 2. Влияние температурына скорость химической реакции
В опыте используется реакция взаимодействия серной кислоты H2SO4 с тиосульфатом натрия Na2S2O3 , протекающая по
уравнению:
H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2↑ + S↓ .
Окончание реакции определяется по появлению помутнения раствора вследствие образования коллоидной серы.
Для выполнения опыта приготовить 6 пробирок. В три из них (1, 2, 3) налить по 5 мл раствора тиосульфата натрия. В три другие (1`, 2`, 3`) налить по 5 мл раствора серной кислоты. Взять первую пару пробирок (1 и 1`) и раствор серной кислоты прилить к раствору тиосульфата натрия. По секундомеру определить время τ от момента сливания растворов до появления мути (мутность раствора развивается постепенно при прохождении реакции, поэтому следует дождаться появления очевидной мутности, запомнить вид раствора при этом, а при сливании двух других пар пробирок определять время реакции при такой же степени мутности). Температуру реакции для первой пары пробирок принять равной комнатной; температуру измерить по термометру в помещении лаборатории (или по термометру, установленному в водяной бане, в которой будет производиться нагревание остальных четырех пробирок при условии, что баня не нагрета).
Остальные четыре пробирки поместить в водяную баню. Нагреть воду до температуры на 10° выше, чем для первой пары
пробирок, после чего выключить газ и выдержать пробирки в нагретой воде в течение двух минут. Затем раствор серной кислоты из пробирки 2` прилить к раствору тиосульфата натрия в пробирке 2. Измерить время до появления мути. Включить газ и продолжить нагревание водяной бани с третьей парой пробирок до температуры на 20° выше, чем для первой пары пробирок. Слить содержимое пробирок (из пробирки 3` в пробирку 3) и определить время
до появления мути. Результаты опыта занести в таблицу по форме таблицы:
| № пары растворов | Температура, t, °С | Промежуток времени от начала отсчета до помутнения, τ, с | Скорость реакции, 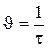 , с–1 , с–1 |
На основании полученных данных построить график зависимости скорости реакции от температуры υ=ƒ(t). Выполнить расчет величины температурного коэффициента γ для двух пар точек: t1 и t3 и какой-либо пары соседних точек (t1 и t2 или t2 и t3). Оценить применимость правила Вант-Гоффа к данной реакции. Сделать вывод о зависимости скорости реакции от температуры.
КОНТРОЛЬНОЕ ЗАДАНИЕ
1. Выразите в математической форме скорость следующих химических реакций:
а) N2 + O2 = 2NO
б) N2 + 3H2 = 2NH3
в) 2С(тверд.) + О2 = 2СО
г) CaO (тверд.) + CO2 (газ) = CaCO3 (тверд.) .
2. Во сколько раз изменится скорость прямой и обратной реакции в системе
2SО2 (газ) + О2 (газ) ↔ 2SО3 (газ)
если объем газовой смеси уменьшить в три раза?
3. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 градусов, если температурный коэффициент реакции равен 2.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Основные понятия: фаза, гомогенная и гетерогенная система, гомогенная и гетерогенная реакция.
2. Определения скорости химической гомогенной и гетерогенной реакции и формулы для расчета.
3. Зависимость скорости химической реакции от концентрации: формулировка и математическая формула. Изменение скорости реакции при увеличении или уменьшении концентрацию одного из реагирующих веществ.
4. Зависимость скорости химической реакции от температуры: формулировка и соответствующая математическая формула. Вычисление температурного коэффициента по данным о скорости химической реакции при двух различных температурах.
