Лекция № 16. Дисперсные системы, коллоидные растворы
Дисперсными (микрогетерогенными) называются системы, в которых частицы одной фазы (дисперсная фаза) равномерно распределены в другой фазе (дисперсионная среда).
По размеру частиц выделяют три типа микрогетерогенных систем:
ü грубодисперсные системы - 10-2 ¸ 10-5 см;
ü мелкодисперсные системы или коллоидные растворы - 10-5 ¸ 10-7 см;
ü истинные или молекулярные растворы - 10-7 ¸ 10-8 см.
Выделение коллоидных растворов в отдельный класс объектов обусловлено двумя причинами:
Во первых, коллоидные растворы характеризуются чрезвычайно большой удельной поверхностью (Sуд = S/V). Для частиц сферической формы Sуд = 6/d. При диаметре частиц 10-4 см Sуд = 6×104 см-1. При уменьшении диаметра до 10-6 см удельная поверхность увеличивается до 6×106 см-1 (600 см2 на 1 см3).
Во-вторых, в микрогетерогенных системах значительная часть молекулярных или атомных частиц вещества находится на поверхности раздела фаз. Очевидно, что свойства вещества в глубине фазы и на ее поверхности будут отличаться. Фактически в коллоидных системах мы имеем дело с принципиально новым состоянием вещества, которое является предметом изучения коллоидной химии - физической химии дисперсных систем и поверхностных явлений.
Изучение коллоидной химии чрезвычайно важно для понимания биологических процессов на молекулярном и субмолекулярном уровне, поскольку биополимеры (белки, полисахариды и нуклеиновые кислоты), вирусы и органеллы клетки, а также клеточные мембраны по сути своей являются микрогетерогенными системами.
Классификация дисперсных (микрогетерогенных) систем проводится по ряду признаков
I. По агрегатному состоянию дисперсной фазы и дисперсионной среды.
| № п/п | Дисперсная фаза/дисперсионная среда | Система |
| Т/Ж | Золи, суспензии | |
| Ж/Ж | Эмульсии | |
| Г/Ж | Пены | |
| Т/Т | Твердые коллоиды, сплавы | |
| Ж/Т | Гели, капиллярные системы | |
| Г/Т | Пористые и капиллярные системы | |
| Т/Г | Пыль, аэрозоли | |
| Ж/Г | Аэрозоли | |
| Г/Г | Флуктуации плотности разреженных газов |
II. По силе взаимодействия между частицами дисперсной фазы различают:
ü свободнодисперсные системы (золи), частицы которых между собой не взаимодействуют;
ü связнодисперсные системы (гели), частицы которых сильно взаимодействуют друг с другом.
III. По природе частиц дисперсной фазы выделяют три группы коллоидных растворов:
ü Суспензоиды - коллоидные растворы неорганических веществ, нерастворимых в обычных условиях (металлы, их оксиды, гидроксиды или соли). Суспензоиды неустойчивы и при удалении дисперсионной среды необратимо разрушаются. По этой причине часто их называют необратимыми коллоидами.
ü Ассоциативные или мицеллярные коллоиды, образованные поверхностно-активными веществами (ПАВ). В качестве ПАВ можно рассматривать мыла, которое представляют собой натриевые или калиевые соли высших карбоновых кислот. В данных веществах можно выделить гидрофильную карбоксильную группу и длинный гидрофобный углеводородный радикал:

При растворении в воде анионы карбоновых кислот стремятся "спрятать" углеводородные радикалы, образуя мицеллы двух типов, в которых гидрофобные группы ориентированы внутрь частицы, а гидрофильные - наружу.
Глобулярные мицеллы Пластинчатые мицеллы
Строение мицеллы позволяет ПАВ растворять вещества, нерастворимые в воде в обычных условиях, за счет капсулирования их в гидрофобные зоны. Данное явление получило название солюбилизации и широко используется для приготовления водных растворов малорастворимых веществ, например, лекарственных препаратов.
ü Молекулярные коллоиды - растворы высокомолекулярных веществ (белки, полимеры и т.д.), молекулы которых имеют размеры коллоидных частиц. После удаления растворителя данные вещества можно перевести в состояние коллоидного раствора, снова добавив растворитель, поэтому молекулярные коллоиды называются обратимыми.
Используют два основных метода получения коллоидных растворов - метод диспергирования (измельчения) и метод конденсации. В методе диспергирования компактное вещество измельчают до размеров коллоидной частицы механически или действием ультразвука. Методом конденсации вещество укрупняется от молекулярного состояния до размеров коллоидной частицы. Обычно используют физическую (конденсация из паров или замена растворителя) или химическую конденсацию, основанную на получении вещества, обычно нерастворимого в воде и выпадающего в осадок, в условиях, способствующих образованию коллоидных растворов. Такими условиями являются:
· образование пересыщенного раствора при использовании сильно разбавленных растворов;
· проведение реакции в избытке одного из реагентов.
Промежуточное положение между методами диспергирования и конденсации занимает электродуговой метод, который используется для получения золей металлов. При этом в подходящий растворитель помещают два металлических электрода, подают на них разность потенциалов, достаточную для образования электрической дуги. В электрической дуге компактный металл испаряется, переходя в атомарное состояние, из которого конденсируется, образуя коллоидные частицы.
Строение коллоидной частицы суспензоида рассмотрим на примере коллоидного раствора сульфата бария, полученного методом химической конденсации при взаимодействии хлорида бария с сульфатом натрия в избытке последнего.
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
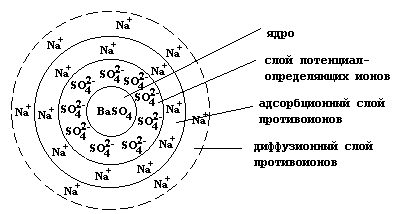
В основе коллоидной частицы лежит ядро - агрегат довольно большого числа (порядка 1000) атомных или молекулярных частиц малорастворимого вещества, в данном случае сульфата бария.
(mBaSO4) - ядро
В обычных условиях ядро представляет собой зародыши кристаллов, быстро увеличивающиеся в размерах, и образующие, в конечном счете, осадок. Использование избытка одного из реагентов приводит к тому, что на поверхности ядра начинается процесс адсорбции ионов из раствора. Адсорбция - это процесс самопроизвольного увеличения концентрации частиц на поверхности раздела фаз. Определить, какой из ионов будет адсорбироваться на поверхности ядра можно по правилу Фаянса-Паннета: в первую очередь на поверхности твердого тела адсорбируются ионы, входящие в состав его кристаллической решетки или изоморфные им. В данном случае в растворе находится избыток сульфата натрия, который диссоциирует на катионы натрия и сульфат-анионы:
Na2SO4 = 2Na+ + SO42-
Очевидно, что в первую очередь на поверхности ядра будут адсорбироваться сульфат-анионы, образующие слой потенциалопределяющих ионов.
[(mBaSO4)nSO42-] - агрегат
Заряженная поверхность агрегата притягивает из раствора катионы натрия, которые образуют два слоя противоионов: адсорбционный, жестко связанный с поверхностью, и диффузионный, частицы которого могут обратимо переходить в раствор. Совокупность ядра и двух адсорбционных слоев называется гранулой, которая собственно и является коллоидной частицей.
{[(mBaSO4)nSO42-]2(n-x)Na+} - гранула
Гранула и диффузионный слой противоионов образуют мицеллу.
{[(mBaSO4)nSO42-]2(n-x)Na+}-2x2xNa+ - мицелла
Схематически строение коллоидной частицы можно представить следующим образом:
Проведение реакции в избытке хлорида бария приведет к тому, что в роли потенциалопределяющих ионов будут выступать катионы бария, а слои противоионов будут образованы хлорид-анионами. Гранула в данном случае заряжена положительно
{[(mBaSO4)nBa2+]2(n-x)Cl-}+2x2xCl-,
а мицелла имеет следующее строение:
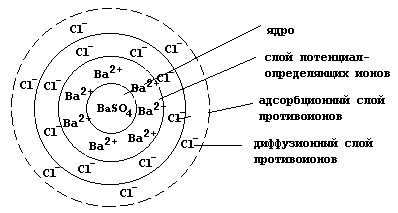
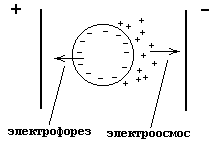
Наличие электрического заряда у гранулы вызывает перемещение коллоидной частицы в электрическом поле. Данное явление называется электрофорезом. Перемещение в электрическом поле ионов диффузионного слоя, увлекающих за собой растворитель, называется электроосмосом.
Поскольку мелкодисперсные системы имеют частицы, размер которых близок к длине видимого света, последний при прохождение через коллоидный раствор рассеивается, образуя светящийся конус (эффект Тиндаля). При этом интенсивность рассеянного света (I) обратно пропорциональна четвертой степени длины волны: I = k/l4. По этой причине коллоидные системы наиболее сильно рассеивают синий свет и менее всего - красный.
С точки зрения термодинамики коллоидные растворы являются метастабильными системами и неустойчивы. Для увеличения устойчивости растворы подвергают очистки. Основной метод их очистки - диализ, который основан на удалении примесей низкомолекулярных соединений через полупроницаемую мембрану (пергамент, целлофан, коллодий и т.д.). Диализ под давлением с использованием мелкопористых фильтров называется ультрафильтрацией. Проведение диализа в электрическом поле (электродиализ) позволяет очистить коллоидный раствор от примесей электролитов.
Тем не менее коллоидные растворы могут сохранятся без изменения длительное время. Относительная устойчивость коллоидных растворов обуславливается рядом факторов.
1. Кинетический фактор устойчивости коллоидных растворов связан с очень малой концентрацией частиц, которая делает малой вероятность их столкновения.
2. Электростатический фактор вызван наличием электростатического заряда на поверхности гранулы, который препятствует сближению и укрупнению частиц.
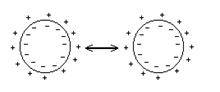
Присутствие в растворе одноименных ионов приводит к "вдавливанию" ионов диффузионного слоя в адсорбционный слой и понижению заряда гранулы. Поэтому посторонние электролиты сильно уменьшают устойчивость коллоидного раствора. Коагулирующее действие электролита характеризуется порогом коагуляции - минимальной его концентрацией, разрушающей коллоидный раствор. Порог коагуляции очень сильно зависит от заряда коагулирующего иона: Cп = К/z6.Для одно-, двух- и трехзарядных ионов пороги коагуляции относятся как 1 : 0,016 : 0,0014.
3. Структурно-механический фактор проявляется в присутствии ПАВ, которые, адсорбируясь на поверхности коллоидных частиц, препятствуют их сближению и укрупнению. Так как поверхностно-активные вещества сами образуют коллоидные растворы, часто их называют защитными коллоидами.
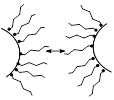
Если все-таки коллоидные частицы смогли преодолеть все факторы устойчивости коллоидного раствора и сблизились на достаточное расстояние, происходит их слияние и укрупнение - коагуляция. Оседание укрупненных частиц разрушенного коллоидного раствора (фактически это уже осадок) называется седиментацией. В ряде случаев процесс коагуляции обратим. Обратный переход коагулянта в коллоидный раствор называется пептизацией.
Литература: [1] с. 295 - 330; [2] с. 254 - 262
