Получение и свойства СОЕДИНЕНИЙ неметаллов
Цель работы: ознакомиться со способами получения и химическими свойствами соединений р-элементов III, IV и V групп периодической таблицы Д.И. Менделеева.
Теоретическая часть
Простые вещества относятся к металлам и неметаллам в зависимости от типа химической связи между атомами. Для металлов характерна металлическая связь, для неметаллов – ковалентная. Как нет резкого различия между металлической и ковалентной связью, так и не может быть резкого различия между металлическими и неметаллическими простыми веществами.
Инструментальные и абразивные материалы, используемые для механической обработки металлов, отличаются от конструкционных (металлических) материалов большей механической прочностью, твердостью, термической и химической стойкостью. Такие свойства имеют вещества, кристаллические решетки которых относятся к атомному типу. Атомный тип кристаллических решеток встречается у элементарных веществ и простых соединений, образованных химическими элементами промежуточного характера, к которым относятся бор, углерод, кремний, германий, сурьма. Электрические свойства веществ, образованных последними тремя элементами, дали возможность использовать их также и в качестве полупроводниковых материалов.
Свойства конструкционных и инструментальных материалов очень сильно зависят от температуры и других условий. Эти зависимости инженеру необходимо хорошо знать, поскольку разнообразные машины, приборы, аппараты и сооружения эксплуатируются в условиях широкого диапазона температур, а иногда и в сильно агрессивных средах.
Бор
Бор в свободном состоянии встречается в виде двух видоизменений -кристаллического и аморфного. По твердости среди элементарных веществ кристаллический бор занимает второе место после алмаза. Аморфный бор представляет собой порошок коричневого цвета.
При высоких температурах бор взаимодействует с кислородом, образуя оксид бора B2O3. При взаимодействии оксида бора с водой образуется слабая борная ортокислота В2О3 +3Н2О=2Н3ВО3.
Соли борной кислоты называются боратами. Тетрабораты, соли тет-раборной кислоты Na2B4O7, образуются при нейтрализации борной орто-кислоты растворами щелочей
4H3BO3 + 2NaOH = Na2B4O7+7Н2О.
Тетраборат натрия образует с 10 молекулами воды кристаллогидрат Na2B4O7 × 10 H2O, называемый обычно бура.
Нитрид бора BN существует в гексагональной и кубической сингонии. Кубический нитрид бора (боразон) благодаря своей исключительной твердости имеет перспективное значение как инструментальный материал.
Углерод
Углерод встречается в виде трех модификаций – алмаз, графит и карбин. Каждая из них отвечает определенному типу гибридизации электронных орбиталей в атомах углерода. При sp3-гибридизации орбиталей образуется кристаллический полимер углерода с атомной координационной кубической решеткой – алмаз. Вследствие sp3-гибридизации электронных орбиталей каждый атом углерода в алмазе образует равноценные прочные s-связи с четырьмя соседними атомами углерода (рис.1).
Такая структура полимера объясняет очень высокую твердость алмаза, отсутствие у него электронной проводимости и крайне низкую энтропию (Sалмаз =2,4 Дж /(моль-К)) по сравнению с другими модификациями углерода.
При sp2-гибридизации орбиталей образуется кристаллический полимер углерода с гексагональной сложной структурой – графит (рис.2).
sp-гибридизация электронных орбиталей в атоме углерода приводит к возникновению прямолинейных цепочек, в которых каждый атом углерода способен к образованию двух s- и двух p-связей. В образовании s-связей участвуют гибридные sp-орбитали, а p-связей - негибридизованные р-орбитали. Кристаллический полимер описанной структуры – карбин. Это черный порошок с плотностью меньшей, а энтропией большей, чем у графита и алмаза. Карбин – полупроводник.
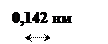
|





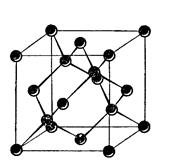
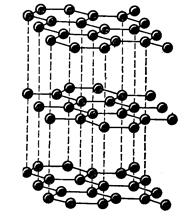
Рис.1.Кристаллическая решетка алмаза Рис. 2.Кристаллическая решетка графита
Своеобразная структура кристаллов графита обуславливает его мягкость, на этом основано его применение в качестве смазочного материала. Между трущимися деталями машин графит измельчается в тончайшие чешуйки, устилающие неровности и облегчающие скольжение трущихся поверхностей.
От смазочных масел графит выгодно отличается относительной термической и химической стойкостью.
Из графита изготавливают различные детали машин, подшипники, поршневые кольца и др. Его применяют как материал для аппаратов химических и металлургических производств теплообменников, тиглей для тугоплавких сплавов и др.
Алмаз благодаря своей исключительной твердости приобрел важное значение как инструментальный материал. С помощью алмазных резцов и сверл обрабатывают различные твердые материалы, окончательно обрабатывают поверхности наиболее ответственных деталей авиационных и автомобильных двигателей. Алмазным инструментом обрабатывают цветные металлы и особо твердые сплавы. Специально ограненные алмазы применяют в качестве деталей очень точных приборов. Алмазный порошок как абразивный материал используют для тонкой обработки различных твердых материалов. Для этого из стали (или меди) изготовляют алмазные круги, в поверхность которых втирается алмазный порошок на специальной цементирующей связке.
Из соединений углерода особое место занимают карбиды.
Карбиды – это соединения углерода с металлами, кремнием, бором. Карбиды щелочных, щелочноземельных элементов (ацетиленида) представляют собой солеподобные соединения с ионным типом связи между углеродом и элементом (кратность связи между атомами углерода равна трем). Поэтому при их взаимодействии с водой образуется ацетилен
СаС2+2Н2О = Са(ОН)2+ С2Н2.
Карбиды алюминия и некоторых других активных металлов также разлагаются водой с образованием углеводородов
Al4C3+ 12H2O = 4 Al(ОН)3+ ЗСН4.
Ацетилениды меди (Cu2С2), серебра (Ag2C2), золота (Au2C2), ртути (HgC) при ударе и нагревании разлагаются со взрывом. Карбиды d-элементов IV-VII групп и группы железа относятся к металлоподобным соединениям, у которых в узлах кристаллических решеток находятся ионы металла, а в пустотах решеток – атомы углерода. Эти соединения имеют интерметаллидный характер переменного состава и характеризуются электрической проводимостью, высокими твердостью и температурой плавления. Например tплТаС равна 3900 оС, а сплава (HfC – 20 % и ТаС-80 %) – 4400 °С. Карбиды обладают химической стойкостью. Так, карбиды тантала, ниобия и гафния не реагируют даже с царской водкой.
Карбиды кремния SiC, бора B4S представляют собой ковалентные соединения и обладают высокой твердостью, жаро- и химической стойкостью.
Карбиды используются в качестве абразивных материалов (B4S), огнеупоров (B4S, ТаС), полупроводниковых материалов (В4С), металлокера-мических твердых сплавов (W2S, TiC, ТаС), как легирующие добавки при получении жаропрочной стали. Карбид кальция СаС2 применяется для получения ацетилена.
Кремний
Кремний в свободном состоянии встречается в кристаллическом и аморфном видоизменениях. Кристаллический кремний (кубическая решетка) имеет высокую твердость и напоминает по внешнему виду темно-серый металл. При комнатной температуре кремнии является полупроводником и используется в полупроводниковой технике.
Оксид кремния SiО2 имеет кислотный характер. Соответствующие ему кремниевые кислоты (мета- H2SiО3, орто- H4SiO4) являются очень слабыми. Оксид кремния совершенно нерастворим в воде, в различных кислотах и очень медленно растворяется в растворах щелочей. При сплавлении со щелочами получаются соли, называемые силикатами, например
|
SiO2:+2NaOH ––® Na2SiO3 + H2O.
Большинство силикатов нерастворимо в воде, лишь силикаты щелочных металлов образуют с водой вязкие растворы, известные под названием жидкое (растворимое) стекло. При действии на эти растворы кислот из них выпадает в виде геля кремниевая кислота
SiO4-4 + 4H+ = H4SiO4¯
Гели кремниевой кислоты представляют собой белую пористую массу-силикагель, обладающую очень большой адсорбционной способностью.
Большое значение имеют искусственно изготовляемые силикаты, среди них стекло. Обыкновенное оконное стекло представляет собой трисиликат натрия - кальция примерного состава Na2Ca(Si3O7)2. Его получают сплавлением песка SiO2 с карбонатами натрия (сода) и карбоната кальция (известняк) при температуре около 1400 °С.
При введении в стеклянную массу оксидов или карбонатов других металлов получают различные специальные сорта стекол. Стекло находится в аморфном состоянии. Однако при термической обработке стекло может приобрести кристаллическую структуру. Такие микрокристаллические материалы, называемые ситаллами, обладают большой прочностью и тугоплавкостью.
Посредством совмещения стекловолокна с различными синтетическими полимерами получают так называемые стеклопластики, отличающиеся легкостью и коррозионной стойкостью. Применяют их в качестве конструкционных материалов.
Важнейшим строительным материалом является силикатный цемент, который получают обжигом смеси известняка и глины. Смеси песка, гравия или щебня с цементом и водой образуют после отвердевания бетон.
Искусственные силикаты широко используются также в виде различного рода керамики. К керамическим изделиям относятся кирпич, гончарные трубы, огнеупорные материалы, а также фарфор и фаянс. Различные виды силикатной керамики используют в металлургическом машиностроении в качестве огнеупоров (динасовые, шамотные и другие изделия).
Силикатные эмали применяют для защиты металлических поверхностей oт действия высокой температуры.
При взаимодействии кремния с азотом при 1000 °С образуется нитрид кремния
3Si+2N2= Si3N4.
Нитрид кремния – тугоплавкое вещество (tпл = 1950 °C), обладающее полупроводниковыми свойствами, химически очень стойкое. При 2000 °С образуется карбид кремния
Si+C= SiC.
Карбид кремния, или так называемый карборунд SiC, имеет чрезвычайно большую твердость (в этом отношении он лишь немногим уступаем алмазу) и химически инертен.
При взаимодействии кремния с большинством металлов при высоких температурах образуются силиды (силициды). Силиды во многом аналогичны карбидам, однако в большей степени, чем последние, напоминают интерметаллические соединения. Эти соединения отличаются значительной твердостью, тугоплавкостью и химической инертностью. Силиды тяжелых металлов применяют для получения твердых жаро- и кислотостойких материалов.
