Комплексные соединения. комплексонометрия
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные, или координационные, соединения. Комплексным соединением называется соединение высшего порядка, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов, и способные к самостоятельному существованию при переходе вещества в расплавленное или растворенное состояние. В координационном соединении различают внутреннюю и внешнюю сферы. Внутренняя сфера включает центральный атом – комплексообразователь – и координирующиеся вокруг него ионы и молекулы, называемыелигандами. Внутреннюю сферу комплекса при написании формулы заключают в квадратные скобки. Как правило, комплексообразователями являются катионы металлов, особенно переходных. Из неметаллов центральным атомом служат чаще всего B, P, Si, As. Лиганды представляют собой анионы или молекулы неорганической или органической природы. Комплексообразователь – обычно акцептор, а лиганды – доноры электронных пар, и при образовании комплекса между ними возникает связь по донорно-акцепторному механизму.
Число лигандов, координированных центральным атомом, - координационное число (К. Ч.) – обычно превышает его степень окисления. Наиболее часто встречаются комплексы с К. Ч. = 6, 4 или 2. Число координационных мест, которые занимает лигандво внутренней сфере, называется емкостью лиганда ( или дентатностью ). Например, в комплексном ионе [Co(NH3)4CO3]+ координационное число равно 6, емкость лиганда NH3 равна 1, а CO3 2- - 2. В комплексном ионе [Co(NH3)5CO3]+ К. Ч. = 6, емкость лигандов NH3 и CO3 2- равна 1.
Комплексное соединение общего вида [MLn]Xm диссоциирует следующим образом:
[MLn]Xm ® [MLn] m+ + m X -.
Сам комплексный ион также способен диссоциировать, но уже как слабый электролит. Комплекс под действием растворителя последовательно теряет лиганды (диссоциация протекает ступенчато), и в конечном итоге этот npoцecc можно выразить следующим образом:
[MLn] m+ « M m+ + n L.
Количественно это равновесие характеризуется общей константой нестойкости комплекса:
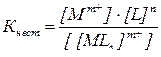 .
.
Чем больше Кнест, тем менее устойчив комплексный ион. Для некоторых соединений (двойные соли) константа нестойкости настолько велика, что они в растворе распадаются на составляющие простые ионы.
Примеры решения задач
Пример 1.
Определите, чему равен заряд комплексного иона и степень окисления комплексообразователя в следующих соединениях: Са[Сu(СN)4].
Решение:
В соединении Са[Сu(СN)4] во внешней сфере находится двухзарядный катион Са2+. Суммарный заряд ионов внешней сферы и комплексного иона должен быть равен нулю. Поэтому комплексный ион имеет заряд 2-: [Cu(CN)4]2–. Комплексообразователем в рассматриваемом соединении является ион меди, а лигандами – цианид-ионы CN– с зарядом 1-. Сумма заряда комплексообразователя (х) и суммарного заряда всех лигандов должна равняться заряду комплексного иона: х + 4∙(–1) = –2 , откуда x = 2, т.е. степень окисления комплексообразователя равна +2 (ион Cu2+).
Ответ: –2, +2.
Пример 2.
Напишите уравнение диссоциации комплексного иона [Zn(NH3)3CN]+. В ответе укажите общее количество ионов и молекул, образующихся при диссоциации.
Решение:
Диссоциация комплексного иона (вторичная диссоциация) происходит с образованием иона комплексообразователя (иона Zn2+), а также лигандов (молекул NH3 и ионов CN–):
[Zn(NH3)3CN]+ 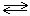 Zn2+ + 3NH3 + CN– .
Zn2+ + 3NH3 + CN– .
Общее количество образовавшихся частиц (молекул и ионов) равно 5.
Ответ: 5.
Пример 3.
Константы нестойкости комплексных соединений [Co(NH3)6]Cl3, K4[Fe(CN)6], К3[Fe(CN)6] соответственно равны: 6,2∙10-36; 1,0∙10-37; 1,0∙10-44. Какое из этих соединений является более прочным?
Решение:
Сравним численные значения констант нестойкости комплексных соединений: Кнест. (К3[Fe(CN)6]) ‹ Кнест. (K4[Fe(CN)6]) ‹ Кнест. ([Co(NH3)6]Cl3). Чем меньше константа нестойкости, тем устойчивее комплексное соединение. Следовательно, более прочным является комплекс К3[Fe(CN)6].
Ответ: К3[Fe(CN)6].
Задачи для самостоятельного решения
1. Какие комплексные соединения образуются в растворе, содержащем ионы: I-, Zn2+, K+, Hg2+, если Кнест.[HgI4]2- = 1,1∙10-18, Кнест.[ZnI4]2- = 1,3∙10-2?
2. Можно ли перевести комплекс [CoCl4]2- в [HgCl4]2-, если их Кнест. соответственно равны 1,4∙10-5 и 1,7∙10-15? Ответ мотивируйте.
3. Расположите комплексные ионы (I, II, III) по мере повышения их устойчивости: Кнест.(I) = 1,58∙10-8 ; Кнест.(II) = 5,01∙10-10 ; Кнест.(III) = 3,16∙10-5 .
4. С какими лигандами Zn2+ образует более прочное соединение: глицин (1), лизин (2), гистидин (3), если Кнест.(1) = 1,1∙10-10, Кнест.(2) = 2,51∙10-8, Кнест.(3) = 1,32∙10-13.
5. Можно ли, вводя в раствор комплекса ртути Na2S2O3, осуществить перевод K2[HgCl4] в K2[Hg(S2O3)2], если Кнест.[HgCl4]2- = 8,5∙10-16 , Kнест.[Hg(S2O3)2]2- =5,9∙10-30?
6. Напишите выражения для констант нестойкости комплексных соединений: [Zn(NH3)4]Br2 и Cu2[Fe(CNS)6)]. По систематической номенклатуре дайте им названия.
7. Напишите биологически активный изомер диаминдихлороплатина, используемый в лечебной практике.
8. Определите, чему равен заряд комплексного иона и степень окисления комплексообразователя в следующих соединениях: а) Mg[CuI4], б) [Pd(NH3)4]SO4, в) [Al(H2O)5Cl]Br2.
9. Напишите формулы следующих комплексных соединений: а) тетрацианодиамминплатинат (II) калия, б) динитротетраакваалюминия (III) бромид. В ответе укажите заряд комплексного иона и координационное число комплексообразователя.
10. Определите, каким станет заряд комплексного иона [Cd(CNS)4]2–, если три роданидных лиганда заменить на три молекулы аммиака.
11. Составьте координационную формулу соединения NiBr2×5NH3, если координационное число комплексообразователя равно 6. В ответе укажите заряд комплексного иона.
12. Напишите уравнение первичной диссоциации в водном растворе комплексной соли Ca2[Fe(CN)6]. В ответе укажите количество образующихся положительно заряженных ионов.
13. Напишите уравнения диссоциации комплексных соединений: [Zn(NH3)4]Cl2, [Cu(NH3)4](OH)2.
14. При отравлении солями тяжелых металлов используют тиосульфат натрия.
15. Какой из ионов - Hg2+ или Ag+ - в первую очередь будет выводиться из организма, если Кнест.[Hg(S2O3)2]2- = 3,6∙10-30; Кнест.[Ag(S2O3)2]3- = 2,5∙10-14?
16. В медицинской практике используется в качестве лиганда ЭДТА и и его соль трилон-Б. С каким катионом: Co3+ (1), Mg2+ (2) – он образует более прочное комплексное соединение, если Кнест.(1) = 2,51∙10-41, Кнест.(2) = 7,59∙10-10?
17. Сравните устойчивость аммиачного (1) и цианидного (2) комплексов, если они имеют следующие константы устойчивости Куст.(1) = 3,6∙106, Куст.(2) = 1,3∙1017.
18. Сравните прочность цианидных комплексов цинка и серебра, если они имеют следующие константы нестойкости: Кнест.[Zn(CN)4]2- = 2,4∙10-20, Кнест.[Ag(CN)2]- = 1,0∙10-21.
19. Константы нестойкости комплексных ионов [Co(CN)4]2-; [Hg(CN)]2-; [Cd(CN)4]2- соответственно равны: 8∙10-20; 4∙10-41; 1,4∙10-17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN- больше? Напишите выражения для констант нестойкости указанных комплексных ионов.
20. При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионное уравнения реакции. Константа нестойкости какого иона:[Zn(NH3)4]2+или [Zn(CN)4]2- больше? Почему?
21. Из сочетания частиц Со3+, NH3, NO-2 и К+ можно составить семь координационных формул комплексных соединений кобальта, одна из которых [Co(NH3)6](NO2)3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах.
Тестовые задания
